题目内容
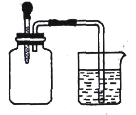
【题目】如图所示,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是 ( )
①H2、O2 ②Cl2、SO2
③NO2、O2 ④N2、H2
A.①②③B.②④
C.③④D.②③
【答案】D
【解析】
将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,可知气体极易溶于水或能够与水反应,据此分析解答。
①H2、O2均不易溶于水,将滴管内的水挤入集气瓶后,烧杯中的水不会进入集气瓶,故①不选;
②Cl2、SO2均能溶于水,且在水中能够发生氧化还原反应,气体体积减小,烧杯中的水会进入集气瓶,故②选;
③NO2、O2 与水能够反应,3NO2 + H2O =2HNO3 + NO或4NO2 + O2 + 2H2O =4HNO3,烧杯中的水会进入集气瓶,故③选;
④N2、H2均不易溶于水,将滴管内的水挤入集气瓶后,烧杯中的水不会进入集气瓶,故④不选;
故选D。

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向NaHS溶液中加入盐酸产生大量气泡 | 氯的非金属性强于硫 |
B | 向溶液中加盐酸酸化的氯化钡溶液产生白色沉淀 | 原溶液中一定含 |
C | 将铁片和铜片用导线连接后插入浓硝酸,铁片表面产生气泡 | 铜的活泼性强于铁 |
D | 常温下测得CH3COONH4溶液pH=7 | 相同温度下CH3COOH和NH3·H2O电离常数相同 |
A.AB.BC.CD.D