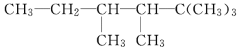题目内容
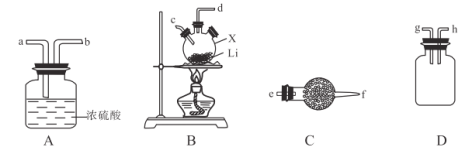
【题目】氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点390℃,沸点430℃,易与水反应,可用锂与氨气加热反应制得。下面是实验室制备LiNH2时可能用到的装置图,回答下列问题:
(1)仅从性质角度分析,下列各组试剂不宜用于实验室制备NH3的是___________(填字母)。
A.浓氨水、Ca(OH)2固体 B.浓氨水、CaO C.NH4Cl固体、Ca(OH)2固体
(2)选用(1)中适宜药品制取出的NH3按气流方向自左向右,则图中装置的连接顺序为___________(填接口处字母)。
(3)装置A的作用是_______________________。
(4)实验开始时,应先通入NH3后加热仪器X,原因是____________________。
(5)氨基锂能与水反应生成LiOH与一种气体,请设计实验证明制备的LiNH2中是否含有金属锂。_________________________________。
【答案】A e→f→c→d→h→g→a(→b) (g、h可颠倒) 吸收多余NH3并阻止空气中水蒸气进入装置B中 避免加热时锂与空气反应 将产物加入足量稀硫酸中,若有气泡产生,说明有金属锂剩余
【解析】
(1)A.Ca(OH)2微溶于水,不易使NH3挥发,因此不宜用于实验室制备NH3,A符合题意;
B.CaO与氨水中的水反应,产生Ca(OH)2,水减少,容易使氨气逸出,且反应放出热量,加速了NH3·H2O分解产生NH3的速率,有利于氨气的逸出,B不符合题意;
C.NH4Cl与Ca(OH)2混合加热发生复分解反应可以产生氨气,适用于在实验室制取氨气,C不符合题意;
故合理选项是A;
(2)制取出的NH3先通过C装置的碱石灰进行干燥,再通入B与Li反应,D是安全瓶,A吸收多余NH3,并阻止空气中水蒸气进入,所以顺序是e→f→c→d→h→g→a(g、h可颠倒)。
(3)装置A的作用是吸收多余NH3并阻止空气中水蒸气进入;
(4)先通入NH3可赶走装置内的空气,避免加热时锂与空气反应;
(5)金属锂在硫酸溶液中会反应生成H2,产生气泡,而氨基锂溶于硫酸生Li2SO4和(NH4)2SO4,不产生气泡,因此检验制备的LiNH2中是否含有金属锂,方法是:将产物加入足量稀硫酸中,若有气泡产生,说明有金属锂剩余。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案【题目】下列各选项中,物质之间通过一步反应就能实现如图所示变化的是( )
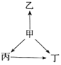
选项 | 甲 | 乙 | 丙 | 丁 |
A | Al | AlCl3 | Al2O3 | NaAlO2 |
B | S | H2S | SO2 | SO3 |
C | Na | Na2O | NaOH | Na2O2 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D