题目内容
11.室温下,下列叙述正确的是( )| A. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液,NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(${HCO}_{3}^{-}$)-c(${CO}_{3}^{2-}$) | |
| B. | pH=2是HA酸溶液与pH=12的MOH碱溶液等体积混合:c(M+)=c(OH-)>c(H+)=c(A-) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(H{CO}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c{(CO}_{3}^{2-})}{c{(HCO}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水②10mL0.2mol/LMgCl2③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
分析 A.根据等浓度等体积的碳酸钠、碳酸氢钠溶液中的物料守恒、电荷守恒判断;
B.需要根据酸和碱是否为强电解质进行讨论;
C.根据碳酸和碳酸氢根离子的电离平衡常数的表达式进行分析;
D.氯离子浓度抑制了氯化银的溶解,则氯离子浓度越大,银离子浓度越小.
解答 解:A.0.1mol•L-1的Na2CO3溶液,NaHCO3溶液等体积混合后的溶液中存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),存在物料守恒:2c(Na+)=3c(H2CO3)+3c(HCO3-)+3c(CO32-),二者结合可得:2c(OH-)-2c(H+)=-3c(H2CO3)+c(HCO3-)-c(CO32-),故A正确;
B.pH=2是HA酸溶液与pH=12的MOH碱溶液等体积混合,若二者都是强电解质,则:c(M+)=c(OH-)>c(H+)=c(A-),若HA为弱酸,则混合液显示酸性,则c(H+)>c(A-);若MOH为弱碱,则混合液中碱过量,溶液显示碱性,则c(H+)<c(A-),故B错误;
C.根据碳酸氢根离子、碳酸的电离平衡常数可得:$\frac{c(H{CO}_{3}^{-})}{c({H}_{2}C{O}_{3})}$=K(H2CO3)•c(H+)、$\frac{c{(CO}_{3}^{2-})}{c{(HCO}_{3}^{-})}$=K(HCO3-)•c(H+),由于同一溶液中,则氢离子浓度相同,根据碳酸的电离平衡常数大于碳酸氢根离子可知,$\frac{c(H{CO}_{3}^{-})}{c({H}_{2}C{O}_{3})}$=K(H2CO3)•c(H+)>$\frac{c{(CO}_{3}^{2-})}{c{(HCO}_{3}^{-})}$=K(HCO3-)•c(H+),故C错误;
D.将足量AgCl分别放入:①5mL水②10mL0.2mol/LMgCl2③20mL0.3mol/L盐酸中溶解至饱和,氯离子浓度越大,则氯化银的溶解度越小,溶液中银离子浓度越小,三种溶液中氯离子浓度大小为:②>③>①,则c(Ag+)大小为:①>③>②,故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及酸碱混合的定性判断及溶液pH的计算、难溶物溶解平衡及其应用、离子浓度大小比较等知识,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案| A. | HCl和NH3 | B. | BeCl2和N2 | C. | CH4和C2H4 | D. | CS2和H2O |
| A. | 气体扩散速率与扩散面积成正比 | |
| B. | 气体扩散速率与气体溶解度和分子量成正比 | |
| C. | 气体扩散速率与分压差成正比 | |
| D. | 气体扩散速率与温度成正比 | |
| E. | 气体扩散速率与扩散距离成反比 |

(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802.0kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=+247.6kJ•mol-1.
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数与温度的关系如下表:
| 温度/℃ | 200℃ | 250℃ | 300℃ |
| 平衡常数/(mol•L-1)2 | K1 | K2 | 80 |
②k1、K2的关系是K1<K2.(填写“>”、“<”或“=”)
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(4)以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应式为CO2+8e-+6H2O=CH4+8OH-.
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 熔点:NaCl>Na>CO2 |
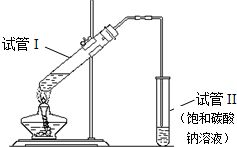 用如图所示的实验装置制备少量乙酸乙酯.请回答有关问题:
用如图所示的实验装置制备少量乙酸乙酯.请回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O. 与
与
 与
与
 与
与
 与
与