题目内容
1.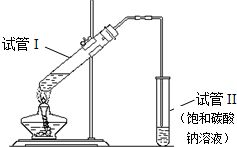 用如图所示的实验装置制备少量乙酸乙酯.请回答有关问题:
用如图所示的实验装置制备少量乙酸乙酯.请回答有关问题:(1)反应中浓硫酸的作用是催化剂、吸水剂.
(2)试管II中导管口为什么要在液面之上?防止倒吸.
(3)写出试管I中反应的化学方程式CH3COOH+C2H5OH
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.(4)该实验使用的乙醇应不含水份,如何检验乙醇是否含有水份取样,加适量无水硫酸铜,若硫酸铜变蓝,则含水,无明显变化则不含水.
分析 (1)浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(2)挥发出来的乙酸和乙醇易溶于水,容易发生倒吸现象;
(3)试管Ⅰ中乙酸和乙醇反应生成乙酸乙酯和水;
(4)通常使用无水硫酸铜检验是否有水生成.
解答 解:(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,
故答案为:催化剂、吸水剂;
(2)乙酸和乙醇易溶于水,容易发生丁烯现象,不插入液面下是为了防止倒吸,
故答案为:防止倒吸;
(3)试管I中乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+C2H5OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(4)检验乙醇是否含有水分的方法为:取样,加适量无水硫酸铜,若硫酸铜变蓝,则含水,若无明显变化,则不含水,
故答案为:取样,加适量无水硫酸铜,若硫酸铜变蓝,则含水,无明显变化则不含水.
点评 本题考查乙酸乙酯的制备,题目难度中等,注意实验的基本操作方法以及浓硫酸混合时的注意事项,明确酯化反应原理为解答关键,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
11.在密闭容器中进行反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A. | Z为0.3 mol•L-1 | B. | Y2为0.4 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
9.100 mL 1 mol•L-1的盐酸与锌粒反应,下列措施能使反应速率加快的是( )
①升高温度
②改用100mL 3mol•L-1的盐酸
③改用300mL 1mol•L-1的盐酸
④改用等量的锌粉代替.
①升高温度
②改用100mL 3mol•L-1的盐酸
③改用300mL 1mol•L-1的盐酸
④改用等量的锌粉代替.
| A. | ①③④ | B. | ①②③ | C. | ②③④ | D. | ①②④ |
16.某物质在空气中充分燃烧生成CO2和H2O,则该物质( )
| A. | 只含碳元素 | B. | 只含氧元素 | ||
| C. | 一定含碳、氢元素,可能含氧元素 | D. | 只含碳、氧两种元素 |
6.下列说法正确的是( )
| A. | 除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 | |
| B. | 含有醛基和羰基的有机物都能跟银氨溶液发生银镜反应 | |
| C. | 苯乙烯分子中所有原子可能在一个平面上 | |
| D. | 甲酸分子中有醛基,因此无法区别甲醛溶液和甲酸溶液 |
11.室温下,下列叙述正确的是( )
| A. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液,NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(${HCO}_{3}^{-}$)-c(${CO}_{3}^{2-}$) | |
| B. | pH=2是HA酸溶液与pH=12的MOH碱溶液等体积混合:c(M+)=c(OH-)>c(H+)=c(A-) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(H{CO}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c{(CO}_{3}^{2-})}{c{(HCO}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水②10mL0.2mol/LMgCl2③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
 、DCH4、ECH3CH3.
、DCH4、ECH3CH3. (1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.高铁电池的负极材料是锌,放电时,正极发生还原(填“氧化”或“还原”)反应.
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.高铁电池的负极材料是锌,放电时,正极发生还原(填“氧化”或“还原”)反应.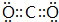 ;用电子式表示化合物 C2D 的形成过程
;用电子式表示化合物 C2D 的形成过程 .
.