��Ŀ����
����Ŀ���Ի�ͭ����Ҫ�ɷֶ�������ͭCuFeS2��Ϊԭ�ϣ���Fe2��SO4��3��Һ����ȡ����ȡͭ���ܷ�Ӧ�����ӷ���ʽ��CuFeS2+4Fe3+Cu2++5Fe2++2S��
��1���÷�Ӧ�У�Fe3+�����ԣ�
��2�������ܷ�Ӧ��ԭ����ͼ1��ʾ�������ĵ缫��Ӧʽ�� ��
��3��һ���¶��£����ƽ�ȡ��pH=1��ȡ������ͬ������ͭ���ĩ�ֱ��������ʵ�飺
ʵ�� | ���� | 2Сʱ��Cu2+������/% |
I | ��������0.10molL��1 Fe2��SO4��3��Һ | 78.2 |
II | ��������0.10molL��1 Fe2��SO4��3��Һ��ͨ����� | 90.8 |
III | ��������0.10molL��1 Fe2��SO4��3��Һ���ټ�������0.0005molL��1 Ag2SO4��Һ | 98.0 |
�ٶԱ�ʵ�� I��II��ͨ�������Cu2+��������ߵ�ԭ���� ��
����ʵ�� III�Ʋ⣬�ڽ�ȡCu2+������Ag+����������ԭ���ǣ�
����CuFeS2+4Ag+�TFe2++Cu2++2Ag2S
����Ag2S+2Fe3+�T2Ag++2Fe2++S
Ϊ֤���ô�ԭ������������ʵ�飺
a��ȡ������ͭ���ĩ����������0.0005molL��1 Ag2SO4��Һ����ֻ�Ϻ��ã�ȡ�ϲ���Һ������ϡ���ᣬ�۲쵽��Һ�� �� ֤��������Ӧ i��
b��ȡ����Ag2S��ĩ��������Һ����ֻ�Ϻ��ã�ȡ�ϲ���Һ������ϡ���ᣬ�а�ɫ������֤��������Ӧ ii��
��4����ʵ�� II�Ľ�ȡҺ�����ȡͭ��ԭ����ͼ2��ʾ�� 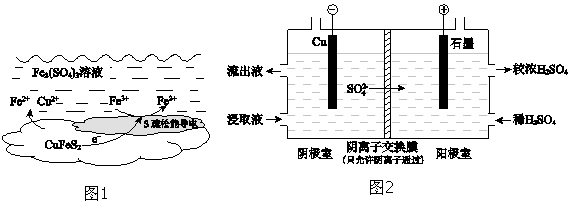
�ٵ����ڣ�����û��ͭ�������õ缫��Ӧʽ����ԭ���� ��
�ڽ������ҵ�����Һ���������ң���ʹ��ȡ��������������ԭ���� ��
���𰸡�
��1������
��2��CuFeS2��4e���TFe2++2S+Cu2+
��3��ͨ��O2��,������Ӧ4Fe2++O2+4H+�T4Fe3++2H2O,c��Fe2+������,c��Fe3+������,�ܷ�Ӧ��ƽ�������ƶ������������� pH=1��0.10mol?L��1Fe2��SO4��3��Һ
��4��Fe3++e���TFe2+�� Fe2+������ʧ��������Fe3+��Fe2+��e���TFe3+,SO42��ͨ�������ӽ���Ĥ����������,Fe2��SO4��3��Һ����
���������⣺��1��CuFeS2+4Fe3+Cu2++5Fe2++2S����Ӧ����Ԫ�ػ��ϼ�+3�۱仯Ϊ+2�ۣ�������������ԭ������ԭ��Ӧ��
���Դ��ǣ���������2��CuFeS2+4Fe3+Cu2++5Fe2++2S��������CuFeS2ʧ���ӷ���������Ӧ���缫��ӦΪ��CuFeS2��4e���TFe2++2S+Cu2+��
���Դ��ǣ�CuFeS2��4e���TFe2++2S+Cu2+����3����һ���¶��£����ƽ�ȡ��pH=1��ȡ������ͬ������ͭ���ĩ����������0.10molL��1 Fe2��SO4��3��Һ��������Ӧ�����������ӡ�ͭ���Ӻ͵����������������ӱ���������Ϊ�����ӣ�ͨ��O2������Ӧ4Fe2++O2+4H+�T4Fe3++2H2O��c��Fe2+�����ͣ�c��Fe3+�����ߣ��ܷ�Ӧ��ƽ�������ƶ���
���Դ��ǣ�ͨ��O2������Ӧ4Fe2++O2+4H+�T4Fe3++2H2O��c��Fe2+�����ͣ�c��Fe3+�����ߣ��ܷ�Ӧ��ƽ�������ƶ���
��a������������
b��pH=1��0.10 molL��1Fe2��SO4��3��Һ����4���ٵ����ڣ�����û��ͭ��������ȡҺ�к������������ӣ������������Դ���ͭ���ȷŵ磬�缫��ӦFe3++e���TFe2+��
���Դ��ǣ�Fe3++e���TFe2+��
�ڽ������ҵ�����Һ���������ң���ʹ��ȡ��������������ԭ����Fe2+������ʧ��������Fe3+��Fe2+��e���TFe3+��SO42��ͨ�������ӽ���Ĥ���������ң�Fe2��SO4��3��Һ������
���Դ��ǣ�Fe2+������ʧ��������Fe3+��Fe2+��e���TFe3+��SO42��ͨ�������ӽ���Ĥ���������ң�Fe2��SO4��3��Һ������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�