题目内容
【题目】根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号: , 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+ , BF3 .
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关反应的离子方程式、 .
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为 . 
【答案】
(1)P;硒
(2)三角锥形;正三角形
(3)Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+; Cu(OH)2+4NH3=Cu(NH3)42++2OH﹣
(4)1:2;3 ![]() :8
:8
【解析】解:(1)第三周期元素中p轨道上有3个未成对电子,则最外层电子排布为3s23p3,应为P元素,外围电子排布是4s24p4,位于周期表第四周期ⅥA族,为硒元素,
所以答案是:P; 硒;(2)根据VSEPR模型得,H3O+的价层电子对=3+ ![]() (6﹣1﹣3×1)=4,有1个孤电子对,所以是三角锥形;BF3的价层电子对=3,且不存在孤电子对,所以是正三角形,
(6﹣1﹣3×1)=4,有1个孤电子对,所以是三角锥形;BF3的价层电子对=3,且不存在孤电子对,所以是正三角形,
所以答案是:三角锥形、正三角形;(3)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=Cu(NH3)42++2OH﹣,
所以答案是:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=Cu(NH3)42++2OH﹣;(4)体心立方晶胞中铁原子个数=1+8× ![]() =2;面心立方晶胞中实际含有的Fe原子个数=6×
=2;面心立方晶胞中实际含有的Fe原子个数=6× ![]() +8×
+8× ![]() =4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比1:2;
=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比1:2;
设体心立方中晶胞的棱长为x,铁原子的直径为A,则3x2=(2A)2,解得x= ![]() ;
;
铁原子直径=A,所以其晶胞体积=R3,面心立方中晶胞的对角线为2A,则其边长= ![]() A,其晶胞体积=2
A,其晶胞体积=2 ![]() A3.
A3.
体心立方的密度与面心立方的密度之比= ![]() :
: ![]() =3
=3 ![]() :8,
:8,
所以答案是:1:2; 3 ![]() :8.
:8.

【题目】将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.
(1)根据部分键能数据和CH4 (g)+4F2 (g)=CF4(g)+4HF(g)的反应热△H为1940kJmol﹣1 , 计算H﹣F键的键能为 .
化学键 | C﹣H | C﹣F | H﹣F | F﹣F |
键能/(kJ.mol﹣1) | 414 | 489 | ? | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,二者均可利用CO和H2反应合成. ①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO32﹣﹣12e﹣═8CO2+3H2O.写出该燃料电池的正极反应式 .
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2 . 某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式 .
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生H2S废气. ①电解池中电极A、B均为惰性电极,其中A为电解池的极;电极B所得到的物质X的分子式为 .
②反应池中发生的离子反应方程式为 . 
【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2+4Fe3+Cu2++5Fe2++2S.
(1)该反应中,Fe3+体现性.
(2)上述总反应的原理如图1所示.负极的电极反应式是 .
(3)一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:
实验 | 操作 | 2小时后Cu2+浸出率/% |
I | 加入足量0.10molL﹣1 Fe2(SO4)3溶液 | 78.2 |
II | 加入足量0.10molL﹣1 Fe2(SO4)3溶液,通入空气 | 90.8 |
III | 加入足量0.10molL﹣1 Fe2(SO4)3溶液,再加入少量0.0005molL﹣1 Ag2SO4溶液 | 98.0 |
①对比实验 I、II,通入空气,Cu2+浸出率提高的原因是 .
②由实验 III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+═Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+═2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005molL﹣1 Ag2SO4溶液,充分混合后静置.取上层清液,加入稀盐酸,观察到溶液中 , 证明发生反应 i.
b.取少量Ag2S粉末,加入溶液,充分混合后静置.取上层清液,加入稀盐酸,有白色沉淀,证明发生反应 ii.
(4)用实验 II的浸取液电解提取铜的原理如图2所示: 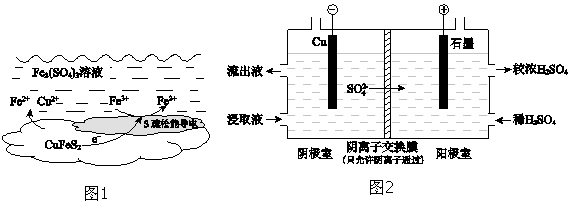
①电解初期,阴极没有铜析出.用电极反应式解释原因是 .
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是 .



