题目内容
【题目】下列化学药品与警示语对应正确的是( )
①酒精——剧毒品 ②浓硫酸——腐蚀品 ③汽油——易燃品 ④烧碱——剧毒品 ⑤氯酸钾——氧化剂 ⑥硝酸铵——爆炸品
A. ①②③⑥ B. ①②⑤ C. ①④⑤ D. ②③⑤⑥
【答案】D
【解析】根据物质的性质确定其对应警示语,②浓硫酸有强腐蚀性——腐蚀品,③汽油是——易燃品,⑤氯酸钾——氧化剂,⑥硝酸铵中氮为+5、—3价,一定条件下易生成氮气——爆炸品,④烧碱具有强碱性、腐蚀性——不属于剧毒品,①酒精易燃、可食用——属于不剧毒品,故正确的是②③⑤⑥,D正确。

 阅读快车系列答案
阅读快车系列答案【题目】将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.
(1)根据部分键能数据和CH4 (g)+4F2 (g)=CF4(g)+4HF(g)的反应热△H为1940kJmol﹣1 , 计算H﹣F键的键能为 .
化学键 | C﹣H | C﹣F | H﹣F | F﹣F |
键能/(kJ.mol﹣1) | 414 | 489 | ? | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,二者均可利用CO和H2反应合成. ①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO32﹣﹣12e﹣═8CO2+3H2O.写出该燃料电池的正极反应式 .
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2 . 某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式 .
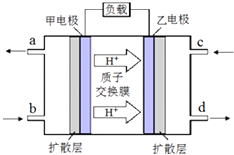
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生H2S废气. ①电解池中电极A、B均为惰性电极,其中A为电解池的极;电极B所得到的物质X的分子式为 .
②反应池中发生的离子反应方程式为 . 
【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2+4Fe3+Cu2++5Fe2++2S.
(1)该反应中,Fe3+体现性.
(2)上述总反应的原理如图1所示.负极的电极反应式是 .
(3)一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:
实验 | 操作 | 2小时后Cu2+浸出率/% |
I | 加入足量0.10molL﹣1 Fe2(SO4)3溶液 | 78.2 |
II | 加入足量0.10molL﹣1 Fe2(SO4)3溶液,通入空气 | 90.8 |
III | 加入足量0.10molL﹣1 Fe2(SO4)3溶液,再加入少量0.0005molL﹣1 Ag2SO4溶液 | 98.0 |
①对比实验 I、II,通入空气,Cu2+浸出率提高的原因是 .
②由实验 III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+═Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+═2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005molL﹣1 Ag2SO4溶液,充分混合后静置.取上层清液,加入稀盐酸,观察到溶液中 , 证明发生反应 i.
b.取少量Ag2S粉末,加入溶液,充分混合后静置.取上层清液,加入稀盐酸,有白色沉淀,证明发生反应 ii.
(4)用实验 II的浸取液电解提取铜的原理如图2所示: 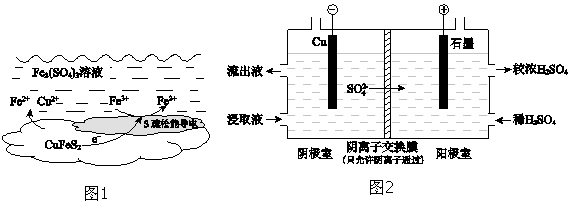
①电解初期,阴极没有铜析出.用电极反应式解释原因是 .
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是 .
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH,液态)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: .
(2)已知化学键的键能为:
化学键 | H﹣H | N﹣H | N≡N |
键能/kJmol﹣1 | 436 | 391 | 945 |
又知反应N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1 . 试根据表中所列键能数据估算a的值为 .
(3)已知:C(s,石墨)+O2(g)═CO2(g)△H=﹣393kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2599kJmol﹣1
根据盖斯定律,计算 298K时C(s,石墨)和H2(g)反应生成1mol C2H2(g)的焓变为 .
【题目】下图是元素周期表的一部分,元素①~⑨在周期表中的位置如图所示(序号代表对应的元素)。
① | |||||||||||||||||
② | ③ | ④ | ⑤ | ||||||||||||||
⑥ | ⑦ | ⑧ | ⑨ | ||||||||||||||
…… | |||||||||||||||||
(1)④在周期表中位于第_____周期_____族。
(2)9种元素中原子半径最大的是______(填元素符号),非金属性最强的是______(填元素符号);
(3)最高价氧化物对应水化物的碱性⑥_____⑦(填“>”或“<”)。
(4)⑧的阴离子的结构示意图为______;③的简单氢化物与⑧的最高价氧化物对应水化物化合生成的盐的化学式为_______。