题目内容
8.下列排列顺序正确的是( )①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④沸点:NH3>ASH3>PH3
⑤晶体的熔点:金刚石>NaCl>CCl4>SO2.
| A. | ②④⑤ | B. | ①②④ | C. | ③⑤ | D. | 全部正确 |
分析 ①元素的非金属性越强,其氢化物的稳定性越强;
②电子层数越多原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强;
④同一主族元素氢化物相对分子质量越大,其熔沸点越高,但含有氢键的氢化物熔沸点最高;
⑤晶体熔沸点:原子晶体>离子晶体>分子晶体,分子晶体熔沸点与其相对分子质量成正比.
解答 解:①元素的非金属性越强,其氢化物的稳定性越强,非金属性F>O>S,所以氢化物的稳定性HF>H2O>H2S,故错误;
②电子层数越多原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,Na、Mg原子有3个电子层、F原子有2个电子层,但Na原子序数大于Mg,所以原子半径Na>Mg>F,故正确;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P,所以酸性:H3PO4<H2SO4<HClO4,故错误;
④同一主族元素氢化物相对分子质量越大,其熔沸点越高,但含有氢键的氢化物熔沸点最高,氨气中含有氢键,熔沸点最高,则熔沸点NH3>ASH3>PH3,故正确;
⑤晶体熔沸点:原子晶体>离子晶体>分子晶体,分子晶体熔沸点与其相对分子质量成正比,金刚石是原子晶体、氯化钠是离子晶体,所以熔沸点金刚石>NaCl>CCl4>SO2,故正确;
故选A.
点评 本题考查晶体熔沸点判断、氢化物的稳定性及最高价含氧酸强弱、原子半径大小判断等知识点,侧重考查学生分析判断及知识运用能力,注意氢键对物质物理性质的影响,氢键不影响化学性质,为易错点.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
14.常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L HCl溶液和20.00mL 0.1000mol/L
CH3COOH溶液,得到2条滴定曲线,如图所示:以下说法正确的是( )
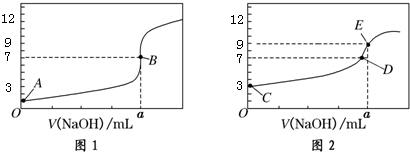
CH3COOH溶液,得到2条滴定曲线,如图所示:以下说法正确的是( )

| A. | 图1是滴定CH3COOH 溶液的曲线 | |
| B. | 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1:100 |
19.下列说法中不正确的是( )
| A. | 离子化合物中不一定含有金属元素 | |
| B. | 由不同原子所形成的纯净物不一定是化合物 | |
| C. | 分子中一定含有化学键 | |
| D. | 含有金属元素的离子不一定是阳离子 |
16.下列说法可以证明反应N2(g)+3H2(g)?2NH3(g)已达到平衡状态的是( )
| A. | 1个N≡N键断裂的同时,有3个H-H键形成 | |
| B. | 1个N≡N键断裂的同时,有3个H-H键断裂 | |
| C. | N2、H2、NH3的分子数之比为1:3:2 | |
| D. | 1个N≡N键断裂的同时,有6个H-N键形成 |
17.用化学用语表达下列微粒,错误的是( )
| A. | 氟离子的结构示意图: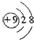 | |
| B. | 氮分子的电子式: | |
| C. | 水分子的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. | C-14原子:${\;}_{6}^{14}$C |
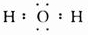
 .
.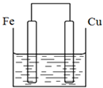 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变). ②C(CH3)4的系统命名:2,2-二甲基丙烷.
②C(CH3)4的系统命名:2,2-二甲基丙烷.