题目内容
5.下列热化学方程式中△H的值能表示可燃物的燃烧热的是( )| A. | 2H2(g)+2Cl2(g)=4HCl(g)△H=-369、2kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |
分析 燃烧热表示1mol可燃物完全燃烧生成稳定氧化物所放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.
解答 解:A.燃烧热表示1mol可燃物完全燃烧生成稳定氧化物放出的热量,HCl不是氧化物,故不符合燃烧热的定义,故A错误;
B.H2O的状态为气态,不是最稳定的氧化物,所以△H不代表燃烧热,故B错误;
C.H2化学计量数为2,所以△H不代表燃烧热,故C错误;
D.CO系数为1,生成产物为二氧化碳,为稳定的氧化物,符合燃烧热的定义,所以△H代表燃烧热,故D正确;
故选:D.
点评 本题考查了燃烧热的概念,题目难度不大,理解此概念是应注意:可燃物的物质的量必须是1mol;生成的产物必须是稳定氧化物,例如碳形成二氧化碳、氢形成液态水.

练习册系列答案
相关题目
16.下列说法可以证明反应N2(g)+3H2(g)?2NH3(g)已达到平衡状态的是( )
| A. | 1个N≡N键断裂的同时,有3个H-H键形成 | |
| B. | 1个N≡N键断裂的同时,有3个H-H键断裂 | |
| C. | N2、H2、NH3的分子数之比为1:3:2 | |
| D. | 1个N≡N键断裂的同时,有6个H-N键形成 |
10.A和M为两种元素,已知A位于短周期,且A2+与M-的电子数之差为8,则下列说法正确的是( )
| A. | A和M的原子序数之差为6 | |
| B. | A和M原子的最外层电子数之差为7 | |
| C. | A和M原子的最外层电子数之和可能为9 | |
| D. | A和M原子的电子总数之和可能为11 |
17.用化学用语表达下列微粒,错误的是( )
| A. | 氟离子的结构示意图: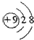 | |
| B. | 氮分子的电子式: | |
| C. | 水分子的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. | C-14原子:${\;}_{6}^{14}$C |
14.在2L密闭容器中,盛有2mol X和2molY物质进行如下反应:X(s)+3Y(g)?Z(g),当反应进行到10s后,测得生成0.5mol Z,这期间的平均反应速率为( )
| A. | v(X)=0.5mol•s-1 | B. | v(X)=0.025mol•L-1•s-1 | ||
| C. | v(y)=0.05mol•L-1•s-1 | D. | v(y)=0.075mol•L-1•s-1 |
15.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2$\stackrel{催化剂}{→}$CO2+H2O.下列有关说法正确的是( )
| A. | 该反应为放热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中只含δ键不含π键 | D. | 设生成1.8gH2O消耗2.24L O2 |
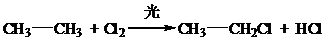 、取代反应
、取代反应 、取代反应.
、取代反应.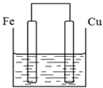 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置(以下均假设反应过程中溶液体积不变).