题目内容
10.下列有关物质的性质和该性质的应用均正确的是( )| A. | 氢氟酸具有强酸性,可用于蚀刻玻璃 | |
| B. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| C. | BaCO3、BaSO4都难溶于水,可用作医疗上的钡餐 | |
| D. | 氧化铝具有很高的熔点,可用于制造熔融烧碱的坩埚 |
分析 A.HF为弱酸;
B.C与二氧化硅反应生成Si和CO;
C.BaCO3与胃酸反应,可溶性钡离子有毒;
D.氧化铝与NaOH反应.
解答 解:A.HF为弱酸,与二氧化硅反应,则可用于蚀刻玻璃,故A错误;
B.C与二氧化硅反应生成Si和CO,反应中C失去电子,则碳具有还原性,所以一定条件下能将二氧化硅还原为硅,故B正确;
C.BaCO3与胃酸反应,可溶性钡离子有毒,不能作钡餐,而BaSO4难溶于水和盐酸,可用作医疗上的钡餐,故C错误;
D.氧化铝与NaOH反应,则制造熔融烧碱的坩埚应为铁坩埚,故D错误;
故选B.
点评 本题考查物质的性质、用途等,为高频考点,综合考查元素化合物知识,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.有A、B、C三种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易腐蚀.将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | B>A>C | B. | A>B>C | C. | A>C>B | D. | C>B>A |
15.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2$\stackrel{催化剂}{→}$CO2+H2O.下列有关说法正确的是( )
| A. | 该反应为放热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中只含δ键不含π键 | D. | 设生成1.8gH2O消耗2.24L O2 |
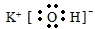 ②C(CH3)4的系统命名:2,2-二甲基丙烷.
②C(CH3)4的系统命名:2,2-二甲基丙烷.
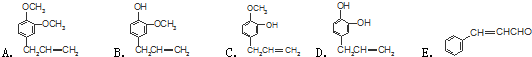
 $\stackrel{反应②}{→}$X,
$\stackrel{反应②}{→}$X,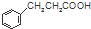 .
.