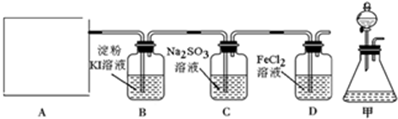
题目内容
12.亚硝酸钠被用作肉制品发色剂、防腐剂等,硝酸钠在肉制品加工中作发色剂.但亚硝酸钠是食品添加剂中急性毒性较强的物质之一,是一种剧毒药,摄取少量亚硝酸盐进入血液后,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧.硝酸钠的毒性作用主要是由于它在食物中、在水中或在胃肠道内被还原成亚硝酸盐所致.亚硝酸钠生产方法是由硝酸生产过程中的氮氧化物气体(NO、NO2)用氢氧化钠或碳酸钠溶液吸收制得.硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得.(1)实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式NaNO2+NH4Cl═NaCl+N2+2H2O;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式2NO2-+2I-+4H+═2NO+I2+2H2O;将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,可观察到溶液的颜色由橙色变为绿色,写出该反应的离子方程式Cr2O72-+3NO2-+8H+═2Cr3++3NO3-+4H2O.
(2)写出氮氧化物(NO、NO2)与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式NO+NO2+2OH-═2NO2-+H2O;若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则反应的离子方程式为2NO2+CO32-═NO2-+NO3-+CO2.
(3)从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是BC.
A.稀盐酸 B.AgNO3溶液 C.稀硝酸 D.氢氧化钠溶液
(4)等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是Na2CO3>NaCl>NaNO2(填溶液中溶质的化学式)
(5)工业品硝酸钠含少量杂质(Na2CO3、NaNO2、NaCl、水不溶物),某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
a.称取8.5g干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL 2.0mol•L-1的A溶液(足量),充分反应后过滤.
b.向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液.c.取10.0mL所配溶液于锥形瓶中,加入少量B物质,再用0.06mol•L-1的Na2S2O3溶液滴定,用去Na2S2O3溶液29.70mL.
有关反应为:I2+2S2O32-═2I-+S4O62-
①A溶液中的溶质的化学式是AgNO3,加入A溶液的作用是使CO32-、Cl-、NO2-转化为沉淀而除去.
②B物质是淀粉,滴定终点时的颜色变化是蓝色→无色.
③若该同学操作正确,但结果造成测定结果略偏高,其原因可能是(任写一点)NO2-未沉淀完全(或滴定过程中带入空气将生成的I-氧化、部分S2O32-与Ag+反应).
分析 (1)加热亚硝酸钠与氯化铵的浓溶液制取氮气,根据化合价变化相等及质量守恒定律配平方程式;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,说明碘离子被亚硝酸钠氧化成碘单质,根据亚硝酸钠的化合价分析可知亚硝酸反应后被氧化成NO;橙色的酸性重铬酸钾溶液具有强氧化性,能够将亚硝酸钠氧化成硝酸钠,同时被还原成铬离子,则溶液由橙色变为绿色,据此写出反应的离子方程式;
(2)氮氧化物(NO、NO2)与氢氧化钠溶液反应生成亚硝酸钠,根据化合价升降相等配平并写出反应方程式;n(NO2)=$\frac{9.2g}{46g/mol}$=0.2mol,该反应中NO2被还原生成NO3-,0.2molNO2反应转移0.1mol电子,则生成n(NO3-)=$\frac{0.1mol}{5-4}$=0.1mol,则剩余0.1mol二氧化氮被氧化生成其它物质,且转移0.1mol电子,则生成物中N元素化合价为+3价,且生成物在水溶液中,应该是亚硝酸根离子,据此书写离子方程式;
(3)亚硝酸钠与硝酸银生成淡黄色沉淀、与氯化钠生成不溶于硝酸的白色沉淀,据此进行解答;
(4)亚硝酸钠、NaCl溶液中,阳离子总电荷浓度之和为:c(H+)+c(Na+),根据电荷守恒,溶液中总阴离子浓度=c(H+)+c(Na+),结合盐的水解情况可知氯化钠溶液中阴离子总浓度大于亚硝酸钠;碳酸钠溶液中,碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,导致溶液中的阴离子浓度增大,则碳酸钠溶液中的阴离子浓度大于NaCl溶液;
(5)①硝酸钠含少量杂质Na2CO3、NaNO2、NaCl,加入A的目的是除去杂质CO32-、Cl-、NO2-,可以选用硝酸银;
②硝酸根离子在酸性条件下能够将碘离子氧化成碘单质,碘单质遇到淀粉显示蓝色,可用淀粉做指示剂;滴定前溶液为蓝色,滴定结束后溶液变为无色;
③测定结果偏高,说明测定出生成的碘单质物质的量偏大或消耗的硫代硫酸根离子的物质的量偏大,据此进行解答.
解答 解:(1)加热亚硝酸钠与氯化铵的浓溶液制取氮气,亚硝酸钠中氮元素的化合价为+3价,铵根离子中氮元素的化合价为-3价,反应生成0价的氮气,则二者的化合价变化相同,反应方程式中二者的计量数相等,结合质量守恒可知该反应的化学方程式为:NaNO2+NH4Cl═NaCl+N2+2H2O;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,反应中生成了碘单质,亚硝酸钠在反应中做氧化剂,氮元素的化合价从+3价降为+2价的NO,反应的离子方程式为:2NO2-+2I-+4H+═2NO+I2+2H2O;酸性重铬酸钾溶液能够将亚硝酸钠氧化成硝酸钠,反应的离子方程式为:Cr2O72-+3NO2-+8H+═2Cr3++3NO3-+4H2O,则溶液由橙色变为绿色,
故答案为:NaNO2+NH4Cl═NaCl+N2+2H2O;2NO2-+2I-+4H+═2NO+I2+2H2O;橙;Cr2O72-+3NO2-+8H+═2Cr3++3NO3-+4H2O;
(2)氮氧化物(NO、NO2)与氢氧化钠溶液反应生成亚硝酸钠,NO变为+3价的亚硝酸钠,化合价升高1价,二氧化氮从+4变为+3价的亚硝酸钠,化合价降低1价,则NO和二氧化氮的计量数相等,该反应方程式为:NO+NO2+2OH-═2NO2-+H2O;
二氧化氮的物质的量为:n(NO2)=$\frac{9.2g}{46g/mol}$=0.2mol,该反应中NO2被还原生成NO3-,0.2molNO2反应转移0.1mol电子,则生成n(NO3-)=$\frac{0.1mol}{5-4}$=0.1mol,则剩余0.1mol二氧化氮被氧化生成其它物质,且转移0.1mol电子,则生成物中N元素化合价为+3价,且生成物在水溶液中,应该是亚硝酸根离子,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,
故答案为:NO+NO2+2OH-═2NO2-+H2O; 2NO2+CO32-═NO2-+NO3-+CO2;
(3)亚硝酸钠与硝酸银溶液反应生成淡黄色的亚硝酸银沉淀,氯化钠与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀AgCl,所以鉴别试剂为硝酸银溶液和稀硝酸,即BC正确,
故答案为:BC;
(4)亚硝酸钠、NaCl溶液中,阳离子总电荷浓度之和为:c(H+)+c(Na+),根据电荷守恒,溶液中总阴离子浓度=c(H+)+c(Na+),由于亚硝酸钠溶液中,亚硝酸根离子部分水解,溶液显示碱性,则亚硝酸钠溶液中的氢离子浓度小于氯化钠,故氯化钠溶液中阴离子总浓度大于亚硝酸钠;碳酸钠溶液中,碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,导致碳酸钠溶液中的阴离子浓度增大,所以碳酸钠溶液中的阴离子浓度大于NaCl溶液,故三种溶液中阴离子浓度大小为:Na2CO3>NaCl>NaNO2,
故答案为:Na2CO3>NaCl>NaNO2;
(5)①烧杯中硝酸钠溶液中混有CO32-、Cl-、NO2-,滴定过程中会影响测定结果,所以需要加入AgNO3溶液,使CO32-、Cl-、NO2-转化为沉淀而除去,
故答案为:AgNO3;使CO32-、Cl-、NO2-转化为沉淀而除去;
②向滤液中加入足量KI溶液和适量稀硫酸,硝酸根离子在酸性条件下具有强氧化性,能够将碘离子氧化成碘单质,碘单质遇到淀粉显示蓝色,所以可加入淀粉作为指示剂;向反应后的溶液中加入淀粉后,溶液变成蓝色,滴定结束后碘单质消失,溶液变成无色,则滴定终点时的颜色变化为:蓝色→无色,
故答案为:淀粉;蓝色→无色;
③若该同学操作正确,但结果造成测定结果略偏高,可能是生成的碘单质的量偏高,如:NO2-未沉淀完全、滴定过程中带入空气将生成的I-氧化,有可能是部分S2O32-与Ag+反应,导致计算出的碘单质的物质的量偏高,计算结果偏高,
故答案为:NO2-未沉淀完全(或滴定过程中带入空气将生成的I-氧化、部分S2O32-与Ag+反应).
点评 本题考查了探究物质组成、测量物质含量的方法,题目难度中等,涉及物质鉴别、离子方程式、化学方程式的书写、中和滴定操作方法及计算等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力,是一道质量结较好的题目.

 阅读快车系列答案
阅读快车系列答案| A. | 使石蕊试液变红 | |
| B. | 与铜反应放出NO气体生成Cu(NO3)2和H2O | |
| C. | 与Na2CO3反应放出CO2气体生成NaNO3和H2O | |
| D. | 与S单质混合共热时生成H2SO4和NO2、H2O |
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | pH=10的Na2CO3溶液:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+$\frac{1}{2}$c(C2O42-) | |
| D. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
| A. | N2的电子式: | B. | F-的结构示意图: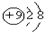 | ||
| C. | 二氧化碳分子的结构式为 O-C-O | D. | NaCl的电子式: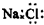 |
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥NH4Cl晶体与Ba(OH)2•8H2O混合搅拌.
| A. | ②③④⑥ | B. | ①②⑥ | C. | ②③④⑤ | D. | ①③⑤ |
| A. | 还原性X-强于Y2- | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质X2能将Y的阴离子Y2-氧化,并发生置换反应 | |
| D. | X的氢化物比Y的氢化物沸点高 |