题目内容
2. 随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.(1)将CO2转化成有机物可有效实现碳循环,CO2转化成有机物的例子有很多,如:
a.6CO2+6H2O$\stackrel{光合作用}{→}$C6H12O6+6O2
b.CO2+3H2$→_{△}^{催化剂}$CH3OH+H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2═CH2+4H2O
在以上属于人工转化的反应中,原子利用率最高的是c(填序号).
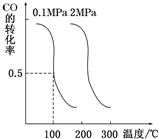
(2)CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为b L的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g),平衡时CO的转化率与温度、压强的关系如图.
①该反应属于放热反应(填“吸热”或“放热”).若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是c(填序号).
a.反应使用催化剂意义不大
b.该反应发生将在很短时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
②100℃时,该反应的平衡常数K=$\frac{{b}^{2}}{{a}^{2}}$(用含a、b的代数式表示).
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
①工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g)?CH3OH(g)△H1=-90.8kJ•mol-1
b.2CH3OH(g)??CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
c.CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-246.4kJ•mol-1.
②对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是cd(填字母).
a.n(CH3OH)=n(CH3OCH3)=n(H2O)
b.容器内压强保持不变
c.H2O(g)的浓度保持不变
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1.
分析 (1)原子利用率最高的是把所有的反应物全部转化为产物;
(2)①由图可知,压强一定时,随温度升高,CO的转化率降低,故升高温度平衡向逆反应移动,据此判断;
②利用三段式计算出平衡时各组分的物质的量,进而求出平衡时各组分的浓度,代入平衡常数表达式计算;
(3)①利用热化学方程式和盖斯定律计算所需热化学方程式,热化学方程式2a+b+c计算得到;
②当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,
a、是某一时刻的特殊值,不能说明反应已达到平衡;
b、任意时刻该反应的压强都不变;不能说明反应已达到平衡;某一物质的浓度保持不变说明达到平衡;
c、浓度不变时为平衡的标志;
d、消耗速率得出CH3OH的正、逆反应速率相等,说明反应达到平衡.
解答 解:(1)原子利用率最高的是把所有的反应物全部转化为产物,原子利用率100%;
a、CO2转化为C6H12O6之外还有氧气产生,故a错误;
b、CO2转化为CH3OH有水产生,故b错误;
c、CO2和CH4反应全部转化为剂CH3COOH,故c正确;
d、CO2和H2反应生成乙烯之外还有水的生成,故d错误;
故答案为:c;
(2)①由图可知,压强一定时,随温度升高,CO的转化率降低,故升高温度平衡向逆反应移动,则正反应为放热反应;
a.可逆反应的平衡常数很大,说明反应进行的程度很大,不能说明该反应在通常条件下一定可以发生,该反应可能需要催化剂才可以进行,故a错误;
b.可逆反应的平衡常数很大,说明反应进行的程度很大,不能说明该条件下反应速率很快,故b错误;
c.可逆反应的平衡常数很大,说明反应进行的程度很大,反应达平衡时至少有一种反应物的百分含量很小,故c正确;
d.可逆反应的平衡常数很大,说明反应进行的程度很大,不能说明该反应是吸热还是放热,故d错误,
故答案为:放热;c;
②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol.
CO(g)+2H2(g)?CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a 0.5a
平衡(mol):0.5a a 0.5a
平衡(mol/L)$\frac{0.5a}{b}$ $\frac{a}{b}$ $\frac{0.5a}{b}$
100℃时该反应的平衡常数k=$\frac{\frac{0.5amol}{bL}}{\frac{0.5amol}{bL}(\frac{amol}{bL})^{2}}$=$\frac{{b}^{2}}{{a}^{2}}$;
故答案为:$\frac{{b}^{2}}{{a}^{2}}$;
(3)①a、2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
b、2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
c、CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ•mol-1
由盖斯定律可知,通过a×2+b+c可得所求热反应方程式,3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-90.8kJ•mol-1×2-23.5kJ•mol-1-41.3kJ•mol-1=-246.4kJ•mol-1;
故答案为:-246.4kJ•mol-1;
②a.达到平衡时,物质的量不变,不是相等,故a错误;
b.该反应是一个反应前后气体体积不变的反应,无论该反应是否达到平衡状态,压强始终不变,所以不能根据平衡体系的总压判断是否达到平衡状态,故b错误;
c.平衡时各物质的浓度不变,故c正确;
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1,符合正逆反应速率相等,故d正确;
故选cd.
点评 本题考查化学平衡图象、化学平衡有关计算、化学平衡常数、影响化学平衡的因素、热化学方程式书写等,是对知识的综合运用,掌握基础是关键,题目难度中等.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| A. | 氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 碳酸氢钠热稳定性弱,用作焙制糕点的发酵粉 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
| A. | ${\;}_{6}^{12}$C与${\;}_{6}^{13}$C | B. | O2与O3 | ||
| C. | 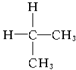 与 与 | D. | 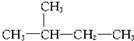 与 与 |
| A. | F的结构示意图 | B. | H2O的分子模型示意图 | ||
| C. | NaCl的电子式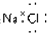 | D. | N2的结构式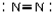 |
| A. | 溴乙烷中加入足量NaOH溶液加热,然后冷却,再加入AgNO3溶液有浅黄色沉淀生成 | |
| B. | 蔗糖溶液中加入稀H2SO4微热,再加少量新制Cu(OH)2浊液煮沸,有红色沉淀生成 | |
| C. | 将红色铜丝在酒精灯上加热后,立即插入无水乙醇中,铜丝恢复成原来的红色 | |
| D. | 用分液漏斗直接分离乙醇和苯的混合液 |
| A. | 10mL 0.1mol/L Na2S2O3中加入10mL0.1mol/L H2SO4 | |
| B. | 5mL 0.1mol/L Na2S2O3中加入5 mL0.1mol/L H2SO4 | |
| C. | 5mL 0.1mol/L Na2S2O3中加入10mL0.05mol/L H2SO4 | |
| D. | 10mL 0.05mol/L Na2S2O3中加入10mL0.1mol/L H2SO4 |


 ,②的反应类型为加成反应
,②的反应类型为加成反应
 (或
(或 )
) ),所得HCNO的结构式是H-N=C=O,分子中氮原子杂化类型为sp2.
),所得HCNO的结构式是H-N=C=O,分子中氮原子杂化类型为sp2. (1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:
(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图: