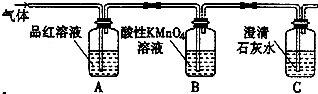
题目内容
12.在相同温度下,下列化学反应速率最慢的是( )| A. | 10mL 0.1mol/L Na2S2O3中加入10mL0.1mol/L H2SO4 | |
| B. | 5mL 0.1mol/L Na2S2O3中加入5 mL0.1mol/L H2SO4 | |
| C. | 5mL 0.1mol/L Na2S2O3中加入10mL0.05mol/L H2SO4 | |
| D. | 10mL 0.05mol/L Na2S2O3中加入10mL0.1mol/L H2SO4 |
分析 发生反应:S2O32-+2H+=S↓+SO2↑+H2O,计算混合后为反应时S2O32-、H+的浓度,温度下相同条件下,浓度越大反应速率愉快.
解答 解:A.混合后为反应时c(S2O32-)=$\frac{0.1mol}{2}$=0.05mol/L,c(H+)=$\frac{0.1mol/L×2}{2}$=0.1mol/L;
B.混合后为反应时c(S2O32-)=$\frac{0.1mol}{2}$=0.05mol/L,c(H+)=$\frac{0.1mol/L×2}{2}$=0.1mol/L;
C.混合后为反应时c(S2O32-)=$\frac{0.1mol/L×5}{5mL+10mL}$=0.033mol/L,c(H+)=$\frac{0.05mol/L×2×10mL}{(5mL+10mL)}$=0.067mol/L;
D.混合后为反应时c(S2O32-)=0.05mol/L×$\frac{1}{2}$=0.025mol/L,c(H+)=0.05mol/L×2×$\frac{1}{2}$=0.05mol/L,
D中S2O32-、H+的浓度均最小,相同温度下,D中反应速率最小,
故选D.
点评 本题考查难度对反应速率的影响,难度不大,注意利用混合后未反应时的浓度,不是混合前各物质的浓度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.在电解水制H2和O2时,为了增强导电性,需加入一些电解质,下列物质可选用( )
| A. | CuSO4 | B. | HC1 | C. | NaCl | D. | NaOH |
7.组成结构可用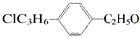 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )
 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )| A. | 25种 | B. | 20种 | C. | 16种 | D. | 14种 |
17.某同学取了一支试管准备做实验,发现里面沾了一些硫磺,便利用如下的反应原理进行淸洗:3S+6NaOH→2Na2S+Na2SO3+3H2O,那么洗涤硫的过程中硫 ( )
| A. | 表现了氧化性 | B. | 表现了还原性 | ||
| C. | 既表现了氧化性又表现了还原性 | D. | 既不表现氧化性也不表现还原性 |
18.下列家庭小实验不能制得溶液的是( )
| A. | 食盐+水 | B. | 泥土+水 | C. | 植物油+汽油 | D. | 蔗糖+水 |
19.下列物质属于纯净物的是( )
| A. | 高锰酸钾完全分解后的残留物 | B. | 洁净的食盐水 | ||
| C. | 冰、水混合物 | D. | 含氮30%的硝酸铵(NH4NO3) |
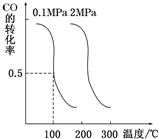 随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.