题目内容
12.下列有关物质的性质和该性质的应用均正确的是( )| A. | 氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 碳酸氢钠热稳定性弱,用作焙制糕点的发酵粉 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
分析 A.根据用浓氨水检验Cl2管道是否泄漏的反应式为3Cl2+8NH3=N2+6NH4Cl来分析;
B.氢氟酸为弱酸;
C.碳酸氢钠不稳定,受热容易分解;
D.铜与浓硝酸常温下就能反应.
解答 解:A.在反应3Cl2+8NH3=N2+6NH4Cl中,氨气做还原剂,表现还原性,故A错误;
B.氢氟酸为弱酸,不具有强酸性,故B错误;
C.碳酸氢钠不稳定,受热容易分解生成碳酸钠、水和二氧化碳,用作焙制糕点的发酵粉,故C正确;
D.铜的金属活动性比铝弱,不可用铜罐代替铝罐贮运浓硝酸,因为铜与浓硝酸发生氧还原反应,而铝在浓硝酸中发生钝化,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉氨气、氢氟酸、碳酸氢钠、浓硝酸的性质是解题关键,注意铝与冷的浓硝酸的钝化反应,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.砹(At)是卤族元素中位于碘之后的元素,试推测砹和砹的化合物最不可能具有的性质是( )
| A. | 砹易溶于某些有机溶剂 | B. | HAt很不稳定,易分解 | ||
| C. | 砹是有色固体,分子式为At2 | D. | AgAt难溶于水,可溶于稀HNO3 |
3.溶液在25℃时由水电离出氢离子的浓度为1×10-12 mol•L-1,下列说法正确的是( )
| A. | 该溶液pH=12 | B. | 该溶液pH=2 | C. | 该溶液pH=12或2 | D. | 不能确定溶液pH |
20.下列离子方程式正确的是( )
| A. | 碳酸氢钠溶液与少量石灰水反应 HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 氯化铵与氢氧化钠两种浓溶液混合加热 NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| C. | 氢氧化镁与稀硫酸反应 H++OH-═H2O | |
| D. | 单质铜与稀硝酸反应 Cu+2H++2NO3-═Cu2++2NO↑+H2O |
7.下列的图示与对应的叙述相符的是( )
| A. |  表示 KNO3 的溶解度曲线,图中 a 点表示的溶液通过升温可以得到 b 点 | |
| B. |  表示某一放热反应,若使用催化剂 E1、E2、△H 都会发生改变 | |
| C. |  表示向 Na2CO3 和 NaHCO3 的混合溶液中滴加稀盐酸时,产生 CO2 的情况 | |
| D. |  表示向 100mL0.1mol/L 的 AlCl3 和 0.1mol/L 的 NH4Cl 混合溶液中滴加 1mol/L 的 NaOH 溶液时 n(Al3+) 和 n(AlO2-)的变化情况 |
17.实验室保存下列试剂,有错误的是( )
| A. | 浓盐酸易挥发,盛在无色密封的玻璃瓶中 | |
| B. | 氟化氢有剧毒,保存在有塑料盖的玻璃瓶中 | |
| C. | 液溴易挥发,盛放在用水封的棕色瓶中 | |
| D. | 碘易升华,保存在棕色瓶中 |
4.下列说法中正确的是( )
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | 具有固定熔点或沸点的物质一定是纯净物 | |
| C. | 一种离子和一种分子的质子数和电子数不可能同时相等 | |
| D. | 共价化合物溶于水电离过程中,共价键被破坏 |
1.随着医用高分子材料的发展,人们用人工器官代替不能治愈的病变器官.目前人们已经制成的人工器官有( )①心脏 ②皮肤 ③骨骼 ④肝 ⑤肾 ⑥眼 ⑦喉.
| A. | ①②③ | B. | ①②⑥ | C. | ②③⑥ | D. | 全部 |
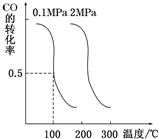 随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.