题目内容
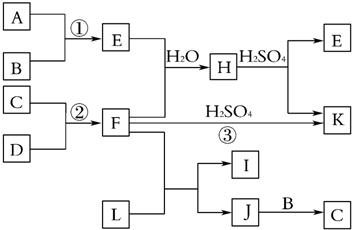
10.某课题小组合成一种复合材料的基体M的结构简式为:

(1)写出A的结构简式
 ,②的反应类型为加成反应
,②的反应类型为加成反应(2)B中含有的官能团有碳碳双键、羧基,D的名称(系统命名)是苯乙烯
(3)写出反应③的化学方程式

(4)写出符合下列条件:①能使FeCl3溶液显紫色;②苯环只有二个取代基;③与新制的Cu(OH)2悬浊液混合加热,有砖红色沉淀生成;④苯环上一氯化物有2种同分异构体.写出有机物B的一种同分异构体的结构简式
 (或
(或 )
)(5)下列说法正确的是acd
a.E与分子式相同的醛互为同分异构体
b.F的分子式为C2H2NO
c.CH2CHNH2能与盐酸反应
d.C分子中苯环上取代基有2个π键.
分析 由苯乙烯及A的产物结构可知,苯乙烯与水发生加成反应生成A的结构简式为: ;反应①为氧化反应,由反应②的反应物及产物结构可知反应②为加成反应,结合M的结构可知C的结构简式为:
;反应①为氧化反应,由反应②的反应物及产物结构可知反应②为加成反应,结合M的结构可知C的结构简式为: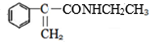 ,结合信息逆推可知B的结构简式为:
,结合信息逆推可知B的结构简式为: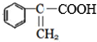 ,据此进行解答.
,据此进行解答.
解答 解:由苯乙烯及A的产物结构可知,苯乙烯与水发生加成反应生成A为 ,反应①为氧化反应,由反应②的反应物及产物结构可知反应②为加成反应,结合M的结构可知C为
,反应①为氧化反应,由反应②的反应物及产物结构可知反应②为加成反应,结合M的结构可知C为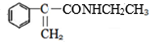 ,结合信息逆推可知B为
,结合信息逆推可知B为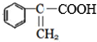 ,
,
(1)由上述分析可知,A的结构简式为: ;反应②为E与HCN反应生成F,反应过程中E中C=O键断裂变成单键,所以该反应为加成反应,
;反应②为E与HCN反应生成F,反应过程中E中C=O键断裂变成单键,所以该反应为加成反应,
故答案为: ;加成反应;
;加成反应;
(2)B的结构简式为: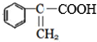 ,其分子中含有碳碳双键和羧基;根据D的结构简式
,其分子中含有碳碳双键和羧基;根据D的结构简式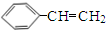 可知,其名称为苯乙烯,
可知,其名称为苯乙烯,
故答案为:碳碳双键、羧基;苯乙烯;
(3)B的结构简式为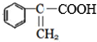 ,C的结构简式为
,C的结构简式为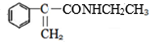 ,则反应③的化学方程式为:
,则反应③的化学方程式为: ,
,
故答案为: ;
;
(4)B为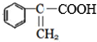 ,其同分异构体符合下列条件:①能使FeCl3溶液显紫色,含有酚羟基③与新制的Cu(OH)2悬浊液混合加热,有砖红色沉淀生成,含有羟基;②只有二个取代基;④苯环上一氯化物有2种同分异构体,则苯环上的两个取代基在对位,符合条件的B的同分异构体为:
,其同分异构体符合下列条件:①能使FeCl3溶液显紫色,含有酚羟基③与新制的Cu(OH)2悬浊液混合加热,有砖红色沉淀生成,含有羟基;②只有二个取代基;④苯环上一氯化物有2种同分异构体,则苯环上的两个取代基在对位,符合条件的B的同分异构体为: 、
、 ,
,
故答案为: (或
(或 );
);
(5)a.E分子中含有羰基,与分子式相同的醛具有不同结构,它们互为同分异构体,故a正确;
b.根据F的结构简式可知,其分子式为C9H9NO,故b错误;
c.CH3CHNH2中含有氨基,所以能够与盐酸反应,故c正确;
d.C的结构简式为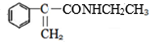 ,该分子中苯环上取代基中含有两个双键,所以含有2个π键,故d正确;
,该分子中苯环上取代基中含有两个双键,所以含有2个π键,故d正确;
故答案为:acd.
点评 本题考查了有机合成,题目难度较大,根据合成流程明确合成原理为解答关键,注意掌握常见有机物结构与性质,明确同分异构体的概念及书写原则,试题培养了学生灵活应用基础知识的能力.

| A. | 碳酸氢钠溶液与少量石灰水反应 HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 氯化铵与氢氧化钠两种浓溶液混合加热 NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| C. | 氢氧化镁与稀硫酸反应 H++OH-═H2O | |
| D. | 单质铜与稀硝酸反应 Cu+2H++2NO3-═Cu2++2NO↑+H2O |
| A. | ①②③ | B. | ①②⑥ | C. | ②③⑥ | D. | 全部 |
(1)现有雨水样品一份,每隔一段时间测定该雨水样品的pH,得数据如下:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②如果将刚取样的上述雨水和自来水相混合,pH将变小,原因是(用化学反应方程式表示)SO2+2H2O+Cl2=H2SO4+2HCl.
(2)你认为减少酸雨产生的途径可采用的措施是C
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③B.②③④⑤C.①③⑤D.①③④⑤
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO2浓度.在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱的结果,地面SO2浓度降低了30%之多.请你从全球环境保护的角度,分析这种方法是否可取?阐述其理由.
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.(1)Y原子核外共有7种不同运动状态的电子,T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).由X、Y、Z形成的离子ZXY?与XZ2互为等电子体,则ZXY?中X原子的杂化轨道类型为sp杂化
(3)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)X单质的晶胞如右图所示,一个X晶胞中有8个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}\root{3}{\frac{12}{P{N}_{A}}}$cm(用代数式表示)

 (其中:-X、-Y均为官能团).
(其中:-X、-Y均为官能团). .
. +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.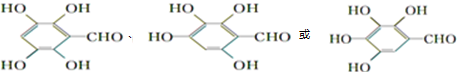 .
.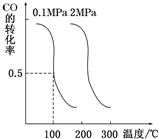 随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.