题目内容
17.按照共用电子对理论,HCNO分子可能有三种同分异构体,分子中每个原子的最外电子层均已饱和,它们的结构可以从其它物质的结构中获得启发.(1)氰化氢(HCN)的结构式是H-C≡N.向其中加入一个氧原子,若形成配位键(用“→”表示),则HCNO的结构式为H-C≡N→O,分子中氮原子杂化类型为sp;若无配位键,则HCNO的结构式为H-O-C≡N,分子中O原子的杂化类型为sp3.
(2)二氧化碳(CO2)的结构式是O=C=O,将氧原子换成等电子的亚氨基(
 ),所得HCNO的结构式是H-N=C=O,分子中氮原子杂化类型为sp2.
),所得HCNO的结构式是H-N=C=O,分子中氮原子杂化类型为sp2.(3)在HCNO的三种可能结构中,碳原子的杂化类型相同(填“相同”或“不同”).
分析 (1)H在化合物中只能形成一对共价键,C可以形成4对共价键,N可以形成3对共价键,O可以形成2对共价键,据此解答即可;
(2)二氧化碳为直线形分子,据此判断结构式,依据N与C核O的成键特点判断HCNO的结构式以及N原子杂化类型;
(3)依据N的成键特点判断N原子杂化类型即可.
解答 解:(1)HCN分子中C原子与N原子之间形成3对共用电子对,C原子与H原子之间形成1对共用电子对,故HCN的结构式是为H-C≡N,向其中插入一个O原子,若形成配位键,N原子通过孤对电子、O原子通过空轨道形成配位键,则HCNO的结构式为H-C≡N→O,分子中N原子成1个σ键、含1对孤对电子,N原子采取sp杂化;若无配位键则HCNO中,O原子应在H-C≡N中H-C键之间插入,其结构式为H-O-C≡N,分子中O原子成2个σ键、含2对孤对电子,O原子采取sp3杂化,
故答案为:H-C≡N;H-C≡N→O;sp;H-O-C≡N;sp3;
(2)CO2的电子式是 ,结构式为O=C=O,将O原子换成等电子的
,结构式为O=C=O,将O原子换成等电子的 ,根据稳定结构可知,N与C之间形成2对共用电子对,故所得HCNO的结构式为 H-N=C=O,分子中N原子成2个σ键、含1对孤对电子,N原子采取sp2杂化,故答案为:O=C=O;H-N=C=O;sp2;
,根据稳定结构可知,N与C之间形成2对共用电子对,故所得HCNO的结构式为 H-N=C=O,分子中N原子成2个σ键、含1对孤对电子,N原子采取sp2杂化,故答案为:O=C=O;H-N=C=O;sp2;
(3)在HCNO的三种可能结构中C原子都成2个σ键、不含孤对电子,C原子均采取sp杂化,故答案为:相同.
点评 本题考查物质结构与性质,涉及分子构型的判断、杂化理论等,难度中等,注意根据σ键、孤对电子判断杂化方式.

练习册系列答案
相关题目
7.下列的图示与对应的叙述相符的是( )
| A. |  表示 KNO3 的溶解度曲线,图中 a 点表示的溶液通过升温可以得到 b 点 | |
| B. |  表示某一放热反应,若使用催化剂 E1、E2、△H 都会发生改变 | |
| C. |  表示向 Na2CO3 和 NaHCO3 的混合溶液中滴加稀盐酸时,产生 CO2 的情况 | |
| D. |  表示向 100mL0.1mol/L 的 AlCl3 和 0.1mol/L 的 NH4Cl 混合溶液中滴加 1mol/L 的 NaOH 溶液时 n(Al3+) 和 n(AlO2-)的变化情况 |
8.下列说法正确的是( )
| A. | AlCl3溶液和NaAlO2溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 用加热煮沸的方法可除去KNO3溶液中混有的Fe3+ | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
5. 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有7种不同运动状态的电子,T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).由X、Y、Z形成的离子ZXY?与XZ2互为等电子体,则ZXY?中X原子的杂化轨道类型为sp杂化
(3)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
(5)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O
(6)X单质的晶胞如右图所示,一个X晶胞中有8个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}\root{3}{\frac{12}{P{N}_{A}}}$cm(用代数式表示)
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2 型氢化物,分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q 原子s能级与p能级电子数相等;G为金属元素;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.(1)Y原子核外共有7种不同运动状态的电子,T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).由X、Y、Z形成的离子ZXY?与XZ2互为等电子体,则ZXY?中X原子的杂化轨道类型为sp杂化
(3)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为正四面体形
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)X单质的晶胞如右图所示,一个X晶胞中有8个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}\root{3}{\frac{12}{P{N}_{A}}}$cm(用代数式表示)
12.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
| A. | 异戊二烯(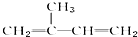 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应 | |
| D. | 邻羟基苯甲酸与NaHCO3溶液反应 |
9.下列有关NaHSO3溶液的叙述正确的是( )
| A. | 该溶液中,K+、Mg2+、Cl2、SO42-可以大量共存 | |
| B. | 已知电离平衡常数K(H2SO3)>K(H2CO3)>K(HSO3-),则该溶液中NH4+、HCO3-、Na+、Cl-不可以大量共存 | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-=CaSO3↓+H2O | |
| D. | 与稀HNO3反应的离子方程式:HSO3-+H+=SO2↑+H2O |
6.下列叙述中错误的是( )
| A. | 离子半径:S2->Cl->O2- | B. | 还原性:Na>Mg>Al | ||
| C. | 沸点:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
7.组成结构可用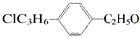 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )
 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )| A. | 25种 | B. | 20种 | C. | 16种 | D. | 14种 |
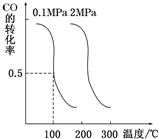 随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.