题目内容
4.下列说法中正确的是( )| A. | 乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍 | |
| B. | NH4+中4个N-H键的键能不相同 | |
| C. | N-O键的极性比C-O键的极性小 | |
| D. | 球棍模型  表示二氧化碳分子,也可以表示二氧化氮分子 表示二氧化碳分子,也可以表示二氧化氮分子 |
分析 A.碳碳双键含有σ键和π键,π键能较小;
B.NH4+中4个N-H键完全相同;
C.原子半径大小与键能的大小有关;
D.二氧化氮分子不是直线形.
解答 解:A.碳碳双键含有σ键和π键,π键能较小,则乙烯中碳碳双键的键能小于乙烷中碳碳单键的键能的2倍,故A错误;
B.NH4+中4个N-H键完全相同,键能相同,故B错误;
C.原子半径N<O,N-O键能较大,故C正确;
D.二氧化碳是直线型分子: ,二氧化氮为V型分子,二者的比例模型不相同,故D错误.
,二氧化氮为V型分子,二者的比例模型不相同,故D错误.
故选C.
点评 本题考查较为综合,涉及共价键的分类以及键能、分子构型等问题,为高考常见题型和高频考点,侧重于双基的考查,有利于培养学生良好的科学素养,难度不大.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
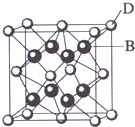
14.KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O2-代替,则下列对于KO2晶体结构的描述正确的是( )
| A. | 与K+距离相等且最近的O2-共有8个 | |
| B. | 与K+距离相等且最近的O2-构成的多面体是正八面体 | |
| C. | 与K+距离相等且最近的K+有8个 | |
| D. | 一个KO2晶胞中的K+和O2-粒子数均为8个 |
12.对于工业合成氨反应:N2+3H2$?_{催化剂}^{高温高压}$2NH3,下列说法错误的是( )
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 增大N2浓度可以使H2转化率达到100% | |
| D. | 增大N2浓度可以增大反应速率 |
19.用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是( )
| A. | 加热 | B. | 滴加少量的CuSO4溶液 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 不用铁片,改用铁粉 |
13.下列叙述正确的是(( )
| A. | O2分子间存在着非极性共价键 | |
| B. | CO2分子内存在着极性共价键 | |
| C. | SO3与H2O反应的产物是离子化合物 | |
| D. | 盐酸中含有H+和Cl-,故HCl为离子化合物 |
14.0.1mol•L-1的下列几种溶液,其pH由大到小的顺序排列正确的是( )
①Na2CO3 ②CH3COONa ③NaCl ④NaHCO3 ⑤NH4Cl.
①Na2CO3 ②CH3COONa ③NaCl ④NaHCO3 ⑤NH4Cl.
| A. | ④>①>②>③>⑤ | B. | ②>①>④>③>⑤ | C. | ③>①>④>②>⑤ | D. | ①>④>②>③>⑤ |
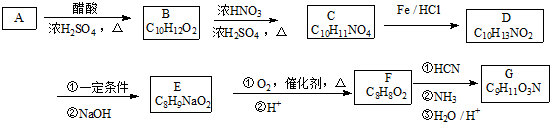
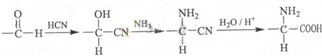
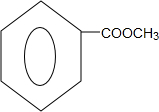
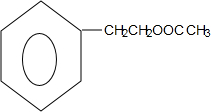 +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$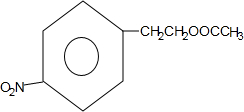 +H2O.
+H2O.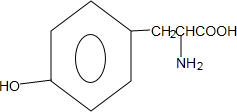 .
. .
. 已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又
已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又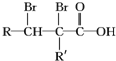 ,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).
,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).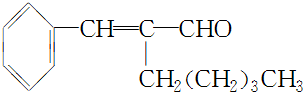 .
. +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH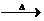
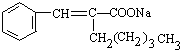 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.