题目内容
12.下列化合物中,熔沸点最高的是( )| A. | NaCl | B. | MgCl2 | C. | NaBr | D. | NaI |
分析 离子晶体熔点高低取决于离子键强弱,阴阳离子带电荷数越多,离子半径越小,离子键越强,熔沸点越高,据此解答.
解答 解:离子晶体熔点高低取决于离子键强弱,阴阳离子带电荷数越多,离子半径越小,离子键越强,熔沸点越高,
NaCl、NaI、NaBr结构相似,氯离子半径小于溴离子、碘离子半径所以氯化钠熔点最高,而氯化钠、氯化镁,钠离子半径大于镁离子半径,镁离子带2个单位正电荷,所以氯化镁熔点高与氯化钠,
故选:B.
点评 本题考查了离子晶体熔点高低判断,明确离子晶体熔点规律是解题关键,题目难度不大.

练习册系列答案
相关题目
2.下列有机物的命名正确的是( )
| A. | 1-甲基戊烷 | B. | 2-乙基-1-丙烯 | ||
| C. | 3,3-二甲基-1-丁醇 | D. | 1,3,5-三硝基甲苯 |
3.把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
| A. | 稀H2SO4 | B. | CuSO4溶液 | C. | AgNO3溶液 | D. | Fe2(SO4)3溶液 |
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,16g O2和32g O3的混合物中,含有O原子数目为3NA | |
| B. | 标准状态下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1mol NaHSO4溶于水或受热熔化,电离出来的离子数目均为2NA | |
| D. | 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71g Cl2,转移的电子数目为$\frac{5}{3}$NA |
7.下列物质中,既能发生消去反应,又能催化氧化生成醛的是( )
| A. | CH3OH | B. | C2H5OH | C. | (CH3)3COH | D. | (CH3)3CCH2OH |
2.X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形成的常见化合物或者离子不可能是( )
| A. | 只含极性键的共价化合物 | |
| B. | 含非极性键的共价化合物 | |
| C. | 阴阳离子个数之比为1:1的离子化合物 | |
| D. | 可形成双核离子或者四核离子 |
9.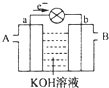 如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )
如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )
 如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )
如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )| A. | a电极发生还原反应,b电极发生氧化反应 | |
| B. | a电极的电极反应式为:CO+4OH-+2e-=CO2+2H2O | |
| C. | A处通入的是空气,B处通入的是CO | |
| D. | 用这种电池作电源精炼铜,若阴极质量增加6.4 g,则至少消耗标准状况下的CO 2.24 L |
6.某食品包装袋上的说明如下:
以下说法不正确的是( )
| 品名 | 苏打饼干 |
| 配料 | 面料、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、苏打 |
| 保质期 | 12个月 |
| 生产日期 | 2015年5月15日 |
| A. | 精炼食用植物油能使溴水和酸性KMnO4溶液褪色 | |
| B. | 白砂糖属于二糖,在人体内水解而转化为单糖 | |
| C. | 鲜鸡蛋清遇浓硝酸变为黄色 | |
| D. | 奶油与白砂糖都是高分子化合物 |
7.将一定量的甲烷和氧气的混合气体置于装有过氧化钠的密闭容器中,用电火花点燃,充分反应后,在1.01×105Pa,120℃时,测得容器中的压强几乎为零,将反应后的剩余固体投入水中也未见有气泡出现.则下列判断中不正确的是( )
| A. | 反应后剩余气体的成分是碳酸钠和氢氧化钠 | |
| B. | 原来混合气体中甲烷和氧气的体积比2:1 | |
| C. | 原来混合气体中甲烷与氧气的体积比为1:2 | |
| D. | 原来的密闭容器中,甲烷、氧气、过氧化钠的物质的量之比为2:1:6 |