题目内容
5.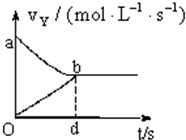 在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)?2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)( )
在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)?2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)( )| A. | 2-Saob | B. | Saob | C. | Sdob | D. | 1-Saob |
分析 由v=$\frac{△c}{△t}$可知,v正与t的乘积为浓度减小量,v逆与t的乘积为浓度增加量,以此分析图中区域面积与Y的变化浓度关系.
解答 解:由v=$\frac{△c}{△t}$可知,v正与t的乘积为浓度减小量,v逆与t的乘积为浓度增加量,所以Saob为正反应Y的浓度减少与逆反应Y的浓度增加的差,即为Y浓度的减少,
故选B.
点评 本题考查图象和反应速率,为高频考点,明确速率与时间的乘积是解答本题的关键,注意把握反应中各物质的量之比的关系,题目难度不大.

练习册系列答案
相关题目
16.下列说法不正确的是( )
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
③将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,放入水中,两者放出的氢气质量相等
④氢氧化铝具有弱碱性,可用于制胃酸中和剂.
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
③将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,放入水中,两者放出的氢气质量相等
④氢氧化铝具有弱碱性,可用于制胃酸中和剂.
| A. | 只有② | B. | 只有②③ | C. | ①②③ | D. | ①②③④ |
10.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
| A. | 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023 | |
| B. | 1L lmol.L-1 FeBr2溶液与l mol氯气反应时转移的电子数为3NA | |
| C. | 标准状况下,11.2L HF所含的分子数约为3.01×1023 | |
| D. | 0.5mol.L-1硫酸钠溶液中含有溶质离子总数为1.5NA |
17.下列说法正确的是( )
| A. | 100℃时,pH=10的NaOH溶液与pH=2的H2SO4溶液等体积混合,则两者恰好中和,溶液的pH=7 | |
| B. | 室温下,将pH=2的盐酸与pH=12的氨水等体积混合后,溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 室温下,pH=3的盐酸与pH=12的NaOH溶液按体积比1:10混合后,溶液pH=7 | |
| D. | 室温下,在pH=11的某溶液中,由水电离出的c(H+)可能为10-3mol/L或10-11mol/L |
15.关于分散系的说法中正确的是( )
| A. | 所有分散系,分散剂必须是液态的 | |
| B. | 胶体区别于其它分散系的本质原因是分散质和分散剂不同 | |
| C. | 从物质分类的角度讲,分散系是混合物 | |
| D. | 所有的分散系都能均匀稳定的长期存在 |
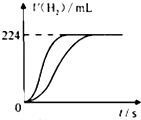 量取8.0mL 5.0mol•L-1H2SO4溶液,加蒸馏水稀释至100mL,取两份稀释后的H2SO4溶液各25mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积).请计算:
量取8.0mL 5.0mol•L-1H2SO4溶液,加蒸馏水稀释至100mL,取两份稀释后的H2SO4溶液各25mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积).请计算: .
.