题目内容
14.A、B、C、D、E为短周期元素,原子序数依次增大.其中A与E同主族,B的最外层电子数是次外层电子数的2倍,C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X.A、B、D、E可组成化合物A2D2、B2A2、E2D2,它们都含有非极性共价键.(1)C元素在周期表中的位置是第二周期VA族,写出B的最高价氧化物的电子式
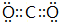 .
.(2)X的水溶液显酸(填“酸”、“碱”或“中”)性,理由是(用离子方程式表示)NH4++H2O?H++NH3.H2O,溶液中各种离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(3)A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式为HCOONa.
(4)火箭推进器中装有液态的C2A4和液态A2D2,它们发生化学反应时生成气态C单质和水蒸气,并放出大量的热.已知0.4mol液态C2A4跟液态A2D2完全反应时,放出256.6kJ热量,该反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.5kJ/mol.
分析 A、B、C、D、E为短周期元素,原子序数依次增大.B的最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X,则C为N元素,X为NH4NO3;A、B、D、E可组成化合物A2D2、B2A2、E2D2,它们都含有非极性共价键,其中A与E同主族,可推知A为H元素,D为O元素,E为Na,据此解答.
解答 解:A、B、C、D、E为短周期元素,原子序数依次增大.B的最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X,则C为N元素,X为NH4NO3;A、B、D、E可组成化合物A2D2、B2A2、E2D2,它们都含有非极性共价键,其中A与E同主族,可推知A为H元素,D为O元素,E为Na.
(1)C为N元素,在周期表中的位置是:第二周期VA族,B的最高价氧化物为CO2,电子式为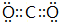 ,
,
故答案为:第二周期VA族;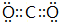 ;
;
(2)X为NH4NO3,其水溶液中NH4+水解:NH4++H2O?H++NH3.H2O,显酸性,溶液中各种离子浓度由大到小的顺序为:c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸;NH4++H2O?H++NH3.H2O;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(3)H、C、O、Na四种元素组成的化合物中原子个数最少的化合物的化学式为HCOONa,
故答案为:HCOONa;
(4)火箭推进器中装有液态的N2H4和液态H2O2,它们发生化学反应时生成气态N2和水蒸气,0.4mol液态肼完全放出256.6KJ的热量,则1mol液态肼放出的热量为256.6kJ×$\frac{1mol}{0.4mol}$=641.5kJ,反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5kJ/mol,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.5kJ/mol.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握常见化合物性质与结构,注意对基础知识的全面掌握,难度中等.

| A. | 用稀硝酸洗涤做银镜反应的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+OH-=AlO2-+2H2O | |
| C. | 用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2O | |
| D. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
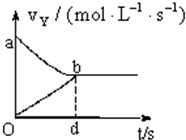 在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)?2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)( )
在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)?2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)( )| A. | 2-Saob | B. | Saob | C. | Sdob | D. | 1-Saob |
| A. | 酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系 | |
| B. | 纯碱、烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应 | |
| C. | 得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性 | |
| D. | 元素的单质可由氧化或还原含该元素的化合物来制得 |
| A. | 与12C化学性质不同 | B. | 与C60互为同素异形体 | ||
| C. | 与12C互为同位素 | D. | 与14N含有的中子数相同 |
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
| A. | c(CH3COO-)>c(NH4+)>c(H+)=c(OH-) | B. | c(NH4+)>c(CH3COO-)>c(H+)=c(OH-) | ||
| C. | c(CH3COO-)=c(NH4+)>c(H+)=c(OH-) | D. | c (CH3COO-)>c(NH4+)>c(H+)>c(OH-) |
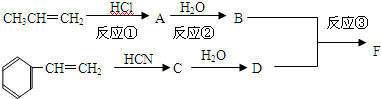
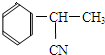 .
. +CH3CHOHCH3$→_{△}^{浓H_{2}SO_{4}}$
+CH3CHOHCH3$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. .
.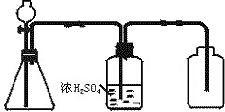 如图是一套实验室制气装置,用于发生、干燥和收集气体,下列各组物质中能利用这套装置进行实验的是①(填代号).
如图是一套实验室制气装置,用于发生、干燥和收集气体,下列各组物质中能利用这套装置进行实验的是①(填代号).