题目内容
16.下列说法不正确的是( )①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
③将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,放入水中,两者放出的氢气质量相等
④氢氧化铝具有弱碱性,可用于制胃酸中和剂.
| A. | 只有② | B. | 只有②③ | C. | ①②③ | D. | ①②③④ |
分析 ①CO2通入溶有足量氨的BaCl2溶液中,反应生成碳酸钡和氯化铵;
②盐酸酸化的氯化钡遇到硫酸根离子、银离子都生成白色沉淀;
③另一块用铝箔包住,Al与NaOH溶液反应生成氢气;
④氢氧化铝具有弱碱性,能中和酸.
解答 解:①CO2通入溶有足量氨的BaCl2溶液中,反应生成碳酸钡和氯化铵,有白色沉淀生成,故①错误;
②盐酸酸化的氯化钡遇到硫酸根离子、银离子都生成白色沉淀,不能确定含有硫酸根离子,故②错误;
③另一块用铝箔包住,Al与NaOH溶液反应生成氢气,则将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量不相等,故③错误;
④胃酸的主要成分是HCl,氢氧化铝具有弱碱性,能中和酸,故④正确;
故选C.
点评 本题考查物质的检验和鉴别,涉及离子的检验、物质的性质,注意③中铝与氢氧化钠反应为解答的难点,题目难度中等.

练习册系列答案
相关题目
7.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| B. | 6.4gS6与S8的混合物中所含S原子数一定为0.4NA | |
| C. | 标准状况下,22.4L苯中含NA个分子 | |
| D. | 1molH2SO4中所含的粒子数目一定是NA |
4.下列离子方程式表达正确的是( )
| A. | 用稀硝酸洗涤做银镜反应的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+OH-=AlO2-+2H2O | |
| C. | 用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2O | |
| D. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
11.下列关于蒸发操作的说法正确的是( )
| A. | 蒸发时,用酒精灯直接将水蒸干以获得晶体 | |
| B. | 实验完毕,用坩埚钳取下蒸发皿于实验桌上,不能用手触碰 | |
| C. | 可以加入沸石或碎瓷片代替玻璃棒搅拌 | |
| D. | 蒸发过程中应用玻璃棒不断搅拌以防止液滴飞溅 |
1.少量铁粉与100mL 0.01mol•L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦把反应器敞开放入100℃水浴中 ⑧改用10mL 0.1mol/L盐酸( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦把反应器敞开放入100℃水浴中 ⑧改用10mL 0.1mol/L盐酸( )
| A. | ①⑥⑦ | B. | ③⑧ | C. | ③⑦⑧ | D. | ⑦⑧ |
8.向一定量铁、氧化铁、四氧化三铁的混合物中加入250ml 2mol/L的硝酸溶液,反应完全后生成1.12LNO(标准状况),再向反应后的溶液中加1mol/L的氢氧化钠溶液,要使铁元素完全沉淀下来,所加NaOH溶液的体积最少是( )
| A. | 400ml | B. | 450ml | C. | 500ml | D. | 无法确定 |
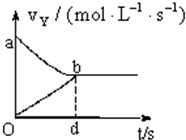 在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)?2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)( )
在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)?2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)( )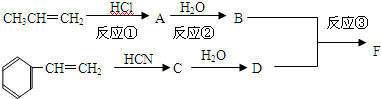
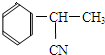 .
. +CH3CHOHCH3$→_{△}^{浓H_{2}SO_{4}}$
+CH3CHOHCH3$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. .
.