题目内容
17.下列说法正确的是( )| A. | 100℃时,pH=10的NaOH溶液与pH=2的H2SO4溶液等体积混合,则两者恰好中和,溶液的pH=7 | |
| B. | 室温下,将pH=2的盐酸与pH=12的氨水等体积混合后,溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 室温下,pH=3的盐酸与pH=12的NaOH溶液按体积比1:10混合后,溶液pH=7 | |
| D. | 室温下,在pH=11的某溶液中,由水电离出的c(H+)可能为10-3mol/L或10-11mol/L |
分析 A、水的电离吸热,温度高于室温,水的离子积常数会升高;
B、室温下,将pH=2的盐酸与pH=12的氨水等体积混合后,得到的是氯化铵和氨水的混合液,显示碱性,据此回答;
C、室温下,pH=3的盐酸与pH=12的NaOH溶液按体积比1:10混合后,根据氢离子和氢氧根离子物质的量的关系来回答;
D、室温下,在pH=11的某溶液可以是碱溶液,还可以是水解显示碱性的盐溶液.
解答 解:A、100℃时,pH=10的NaOH溶液与pH=2的H2SO4溶液等体积混合,氢离子和氢氧根离子物质的量相等,则两者恰好中和,此时溶液的pH=6,故A错误;
B、室温下,将pH=2的盐酸与pH=12的氨水等体积混合后,得到的是氯化铵和氨水的混合液,显示碱性,c(NH4+)>c(Cl-)>c(OH-)>c(H+),故B错误;
C、室温下,pH=3的盐酸氢离子浓度是0.001mol/L,pH=12的NaOH溶液氢氧根离子浓度是0.01mol/L,二者按体积比1:10混合后,氢离子和氢氧根离子物质的量不等,碱剩余,所以溶液pH>7,故C错误;
D、室温下,在pH=11的某溶液可以是碱溶液,水电离出的c(H+)可能为10-11mol/L,还可以是水解显示碱性的盐溶液,水电离出的c(H+)可能为10-3mol/L,故D正确.
故选D.
点评 本题考查学生酸碱混合后溶液的pH的计算以及盐的水解原理的应用等方面的知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
7.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| B. | 6.4gS6与S8的混合物中所含S原子数一定为0.4NA | |
| C. | 标准状况下,22.4L苯中含NA个分子 | |
| D. | 1molH2SO4中所含的粒子数目一定是NA |
8.向一定量铁、氧化铁、四氧化三铁的混合物中加入250ml 2mol/L的硝酸溶液,反应完全后生成1.12LNO(标准状况),再向反应后的溶液中加1mol/L的氢氧化钠溶液,要使铁元素完全沉淀下来,所加NaOH溶液的体积最少是( )
| A. | 400ml | B. | 450ml | C. | 500ml | D. | 无法确定 |
5.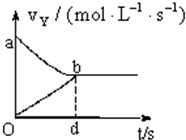 在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)?2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)( )
在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)?2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)( )
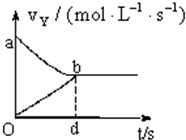 在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)?2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)( )
在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)?2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)( )| A. | 2-Saob | B. | Saob | C. | Sdob | D. | 1-Saob |
2.下列有关分类和氧化还原的描述正确的是( )
| A. | 酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系 | |
| B. | 纯碱、烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应 | |
| C. | 得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性 | |
| D. | 元素的单质可由氧化或还原含该元素的化合物来制得 |
9.考古学家可以通过测定古生物化石中14C的含量确定古生物生活的年代.下列关于14C的说法正确的是( )
| A. | 与12C化学性质不同 | B. | 与C60互为同素异形体 | ||
| C. | 与12C互为同位素 | D. | 与14N含有的中子数相同 |

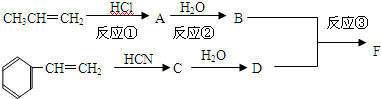
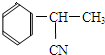 .
. +CH3CHOHCH3$→_{△}^{浓H_{2}SO_{4}}$
+CH3CHOHCH3$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. .
.