题目内容
18.KMnO4是常见的试剂.某小组拟用酸性KMnO4溶液与H2C2O2(K2=5.4×10-2)的反应(此反应为热效反应)来探究“条件对化学反应速率的影响”并设计了如下的方案记录实验结果(忽略溶液混合体积变化)限选试剂和仪器:0.20mol/l KMnO4 溶液(酸性)蒸馏水、试管、量筒、秒表、恒温水浴槽| 物理量 编号 | V(0.20mol/L H2C2O4溶液)/mL | 甲 | V(O.O1mol/L KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 5.0 | |
| ② | 2.0 | 0 | 4.0 | 0 | 2.5 | |
| ③ | 1.0 | a | 4.0 | 0 | 2.5 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 2.5 |
(1)完成上述反应原理的离子反应方程式
□MnO4-+□5H2C2O2+□6H+=□Mn2-+□CO2↑+□H2
(2)上述实验①②是温度探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则表格中“甲”应填写V(蒸馏水)/mL,a为1.0;乙是实验需要测量的物理量,则表格中“乙”应填
写溶液褪色的时间
(3)上述实验②④是探究催化剂对化学反应速率的影响,请在答题卷的坐标图1中画出②和④的能量变化关系图(做必要的标注)
Ⅱ某化学小组利用图2装置进行实验证明氧化性;KMnO4>Cl2>Br2,限选试剂:KBr溶液、KMnO4.浓盐酸、浓硫酸
(4)装置a、d中盛放的试剂分别是:浓盐酸、KBr溶液;试验中观察到的现象为c中有黄绿色气体产生,d中溶液变为棕黄色;此实验装置的不足之处是无尾气处理装置

分析 (1)酸性KMnO4溶液与H2C2O2发生氧化还原反应,MnO4-被还原为Mn2+,H2C2O2被氧化为CO2,结合离子方程式的电荷守恒和反应环境可知,要有H+参与反应,根据得失电子数守恒和电荷守恒来配平;
(2)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致;要探究H2C2O4溶液浓度不同对反应速率的影响,则加入的H2C2O4溶液的体积不同,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积均为6mL;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短.
(3)使用催化剂只能降低反应的活化能,不能改变反应物、生成物的能量以及反应放出的热量,据此分析;
(4)根据在氧化还原反应中,氧化剂的氧化性强于氧化产物,故要实验证明氧化性;KMnO4>Cl2>Br2,需用KMnO4将Cl2氧化出,用Cl2将Br2氧化出,据此分析;根据反应来分析现象;由于氯气、溴蒸汽有毒,故应有尾气处理.
解答 解:(1)酸性KMnO4溶液与H2C2O2发生氧化还原反应,MnO4-被还原为Mn2+,H2C2O2被氧化为CO2,结合离子方程式的电荷守恒和反应环境可知,要有H+参与反应,根据得失电子数守恒和电荷守恒来配平可得:2MnO4-+5H2C2O2+6H+=2Mn2++10CO2+8H2O,故答案为:2MnO4-+5H2C2O2+6H+=2Mn2++10CO2+8H2O;
(2)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,通过比较实验①②的反应条件可知,实验①②可探究温度对反应速率的影响;实验②③中的H2C2O4溶液的加入体积不同,故要探究H2C2O4溶液浓度不同对反应速率的影响,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积均为6mL,故甲应为V(蒸馏水)/mL,a的值为1.0;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短,故乙要测量的物理量是溶液褪色的时间,
故答案为:温度;V(蒸馏水)/mL;1.0;溶液褪色的时间;
(3)使用催化剂只能降低反应的活化能,不能改变反应物、生成物的能量以及反应放出的热量,故图象为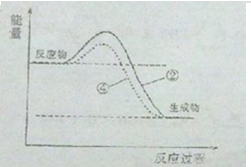 ,
,
故答案为: ;
;
(4)根据在氧化还原反应中,氧化剂的氧化性强于氧化产物,故要实验证明氧化性;KMnO4>Cl2>Br2,需用KMnO4将Cl2氧化出,用Cl2将Br2氧化出,故a中应放浓盐酸,c中放KMnO4溶液,通过KMnO4能将浓盐酸中的Cl-氧化为Cl2可证明氧化性KMnO4>Cl2;d中放KBr溶液,通过Cl2与KBr溶液反应置换出Br2可以证明氧化性Cl2>Br2,
由于c中有氯气生成,即有黄绿色气体产生,在d中氯气将KBr溶液氧化为单质溴,溶液变为棕黄色.由于氯气、溴蒸汽有毒,故应有尾气处理装置.
故答案为:浓盐酸;KBr溶液;c中有黄绿色气体产生,d中溶液变为棕黄色;无尾气处理装置.
点评 本题考查了影响反应速率的因素的探究,应注意的是当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致.综合性较强,难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | C2H4Cl2 | B. | C2H3Cl3 | C. | C2HCl3 | D. | C2H2Cl2 |
| A. | Fe3+、K+、Br-、SCN- | B. | NH4+、Na+、CO32-、OH- | ||
| C. | K+、Na+、PO43-NO3- | D. | Al3+、Mg2+、SO42-HCO3- |
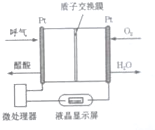
| A. | 电流由O2所在的铂电极流出 | |
| B. | O2所在的铂电极处发生还原反应 | |
| C. | 该电池的负极反应式为CH3CH2OH+3H2O-12e-=2CO2↑+12H+ | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量. |
| A. | K+、OH-、Cl-、SO42- | B. | H+、NH4+、Al3+、NO3- | ||
| C. | Na+、S2-、Cl-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
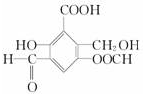 取Na、NaOH、新制的Cu(OH)2分别与等质量的A在一定条件下充分反应时,理论上所需Na、NaOH、新制Cu(OH)2的物质的量的比为8:10:7.
取Na、NaOH、新制的Cu(OH)2分别与等质量的A在一定条件下充分反应时,理论上所需Na、NaOH、新制Cu(OH)2的物质的量的比为8:10:7.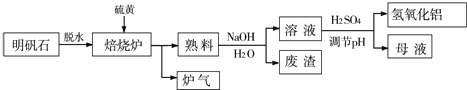

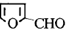 )与丙二酸合成香料过程中发生了
)与丙二酸合成香料过程中发生了
 (或
(或 、
、 ).
). CH3CH2OOCCH2COOCH2CH3+2H2O.
CH3CH2OOCCH2COOCH2CH3+2H2O. )与丙二酸可发生类似反应①的反应,写出有机产物的结构简式
)与丙二酸可发生类似反应①的反应,写出有机产物的结构简式 .
.