题目内容
10.糠醛(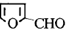 )与丙二酸合成香料过程中发生了
)与丙二酸合成香料过程中发生了反应①:

(1)糠醛的分子式为C5H4O2,1mol糠醛最多能与3mol H2反应.
(2)关于化合物Ⅰ的说法正确的是BD.
A.核磁共振氢谱中有4组信号峰
B.能使酸性KMnO4溶液褪色
C.能发生加聚反应和缩聚反应
D.能发生取代反应和加成反应
(3)芳香化合物Ⅱ是化合物Ⅰ的同分异构体,能发生银镜反应,遇FeCl3溶液显紫色,任写一个Ⅱ的结构简式
 (或
(或 、
、 ).
).(4)下面是由ClCH2CH2COOH合成丙二酸二乙酯的过程:
ClCH2CH2COOH$\stackrel{反应②}{→}$HOCH${\;}_{{2}_{\;}}$CH2COONa$→_{酸化}^{氧化}$HOOCCH2COOH$→_{C_{2}H_{5}OH}^{反应③}$丙二酸二乙酯,反应②的条件是氢氧化钠水溶液、加热,反应③的化学方程式为HOOCCH2COOH+2CH3CH2OH
 CH3CH2OOCCH2COOCH2CH3+2H2O.
CH3CH2OOCCH2COOCH2CH3+2H2O.(5)水杨醛(
 )与丙二酸可发生类似反应①的反应,写出有机产物的结构简式
)与丙二酸可发生类似反应①的反应,写出有机产物的结构简式 .
.
分析 (1)根据结构简式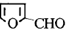 判断含有的C、H、O数目,形成其分子式;碳碳双键和醛基都能够与氢气发生加成反应,1mol糠醛分子中含有2mol碳碳双键、1mol醛基,能够消耗3mol氢气;
判断含有的C、H、O数目,形成其分子式;碳碳双键和醛基都能够与氢气发生加成反应,1mol糠醛分子中含有2mol碳碳双键、1mol醛基,能够消耗3mol氢气;
(2)化合物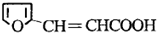 中含有碳碳双键、羧基,根据有机物官能团与性质的关系判断;
中含有碳碳双键、羧基,根据有机物官能团与性质的关系判断;
(3)能发生银镜反应,该有机物分子中含有醛基,遇FeCl3溶液显紫色,分子中含有酚羟基,结合化合物Ⅰ的结构简式写出满足条件的有机物的结构简式;
(4)根据制备流程可知,反应②为卤代烃的水解反应,应该在氢氧化钠的水溶液、加热条件下进行;反应③为HOOCCH2COOH和2CH3CH2OH发生酯化反应生成CH3CH2OOCCH2COOCH2CH3和2H2O;
(5)该反应的方程式为: +
+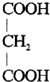 $→_{90℃}^{催化剂}$
$→_{90℃}^{催化剂}$ +CO2↑+H2O.
+CO2↑+H2O.
解答 解:(1)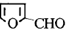 分子中含有5个C、4个H和2个O,其分子式为:C5H4O2;1mol
分子中含有5个C、4个H和2个O,其分子式为:C5H4O2;1mol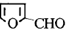 中含有2mol碳碳双键、1mol醛基,所以1mol糠醛与完全反应消耗3mol氢气,
中含有2mol碳碳双键、1mol醛基,所以1mol糠醛与完全反应消耗3mol氢气,
故答案为:C5H4O2;3;
(2)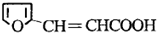 分子中含有3个碳碳双键、1个羧基,
分子中含有3个碳碳双键、1个羧基,
A.化合物Ⅰ分子中含有6种等效H原子,其核磁共振氢谱中有6组信号峰,故A错误;
B.该有机物分子中含有碳碳双键,能够被酸性高锰酸钾溶液氧化,所以能使酸性KMnO4溶液褪色,故B正确;
C.含有碳碳双键,能发生加聚反应,但是只含有1个羧基,不能发生缩聚反应,故C错误;
D.该有机物分子中含有碳碳双键,能够发生加成反应,含有羧基,能够发生酯化反应,酯化反应也属于取代反应,故D正确;
故答案为:BD;
(3)芳香化合物Ⅱ是化合物Ⅰ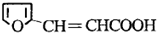 的同分异构体,能发生银镜反应,分子中含有醛基;遇FeCl3溶液显紫色,分子中含有酚羟基,满足条件的有机物结构简式为:
的同分异构体,能发生银镜反应,分子中含有醛基;遇FeCl3溶液显紫色,分子中含有酚羟基,满足条件的有机物结构简式为:
 、
、 ,
,
故答案为: (或
(或 、
、 );
);
(4)根据流程ClCH2CH2COOH$\stackrel{反应②}{→}$HOCH${\;}_{{2}_{\;}}$CH2COONa$→_{酸化}^{氧化}$HOOCCH2COOH$→_{C_{2}H_{5}OH}^{反应③}$丙二酸二乙酯可知,反应②为氯原子被羟基取代,卤代烃的水解反应,反应条件为氢氧化钠的水溶液、加热;反应③为HOOCCH2COOH和2CH3CH2OH的酯化反应,反应方程式为:HOOCCH2COOH+2CH3CH2OH CH3CH2OOCCH2COOCH2CH3+2H2O,
CH3CH2OOCCH2COOCH2CH3+2H2O,
故答案为:NaOH水溶液、加热;HOOCCH2COOH+2CH3CH2OH CH3CH2OOCCH2COOCH2CH3+2H2O;
CH3CH2OOCCH2COOCH2CH3+2H2O;
(5)水杨醛(  )与丙二酸可发生类似反应①的反应,则
)与丙二酸可发生类似反应①的反应,则 与丙二酸反应生成
与丙二酸反应生成 、二氧化碳气体和水,反应方程式为:
、二氧化碳气体和水,反应方程式为: +
+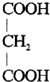 $→_{90℃}^{催化剂}$
$→_{90℃}^{催化剂}$ +CO2↑+H2O,
+CO2↑+H2O,
故答案为: .
.
点评 本题考查了有机合成,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握同分异构体的书写原则,能够根据要求正确书写反应的化学方程式,试题侧重考查学生的分析、理解能力.

| A. |  | B. | CH3COOCH2CH3 | C. |  | D. |  |
| 物理量 编号 | V(0.20mol/L H2C2O4溶液)/mL | 甲 | V(O.O1mol/L KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 5.0 | |
| ② | 2.0 | 0 | 4.0 | 0 | 2.5 | |
| ③ | 1.0 | a | 4.0 | 0 | 2.5 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 2.5 |
(1)完成上述反应原理的离子反应方程式
□MnO4-+□5H2C2O2+□6H+=□Mn2-+□CO2↑+□H2
(2)上述实验①②是温度探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则表格中“甲”应填写V(蒸馏水)/mL,a为1.0;乙是实验需要测量的物理量,则表格中“乙”应填
写溶液褪色的时间
(3)上述实验②④是探究催化剂对化学反应速率的影响,请在答题卷的坐标图1中画出②和④的能量变化关系图(做必要的标注)
Ⅱ某化学小组利用图2装置进行实验证明氧化性;KMnO4>Cl2>Br2,限选试剂:KBr溶液、KMnO4.浓盐酸、浓硫酸
(4)装置a、d中盛放的试剂分别是:浓盐酸、KBr溶液;试验中观察到的现象为c中有黄绿色气体产生,d中溶液变为棕黄色;此实验装置的不足之处是无尾气处理装置

| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 浓硫酸具有吸水性,因而能使蔗糖碳化 | |
| B. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 | |
| C. | 在反应SO2+2H2S═3S+2H2O中SO2作氧化剂 | |
| D. | 硫粉在过量的纯氧中燃烧可以生成SO3 |
| 酸 | CH3COOH | HCN | HF | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | 6.6×10-4 | Ka1=4.3×10-2Ka2=5.6×10-11 |
| A. | 5种钠盐溶液pH大小关系pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)>pH(NaF) | |
| B. | 2mol•L-1HCN与1mol•L-1NaOH溶液等体积混合后的溶液中:c(CN-)<c(Na+)<c(HCN) | |
| C. | 向Na2CO3溶液中滴加过量的HCN溶液;2HCN+Na2CO3=2NaCN+CO2↑+H2O | |
| D. | 含等物质的量的Na2CO3、NaHCO3的混合液中:2c(Na+)=3c(CO32-)+3C(HCO3-) |
| A. | 白磷、硅 | B. | 碳化硅、硫酸钠 | C. | 水晶、金刚石 | D. | 碘、汞 |

 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$
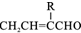
 .
. .
.