题目内容
8.将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )| A. | K+、OH-、Cl-、SO42- | B. | H+、NH4+、Al3+、NO3- | ||
| C. | Na+、S2-、Cl-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
分析 根据离子之间不能结合生成沉淀、气体、水等,能大量共存,并结合足量CO2通入仍不反应来解答.
解答 解:A.该组离子之间不反应,可大量共存,且足量CO2通入与OH-反应,不能共存,故A不选;
B.该组离子之间不反应,可大量共存,且足量CO2通入仍不反应,能大量共存,故B选;
C.该组离子之间不反应,可大量共存,且足量CO2通入与S2-反应,不能共存,故C不选;
D.该组离子之间不反应,可大量共存,且足量CO2通入与C6H5O-反应,不能共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,注意酸性的强弱,题目难度不大.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目
18.KMnO4是常见的试剂.某小组拟用酸性KMnO4溶液与H2C2O2(K2=5.4×10-2)的反应(此反应为热效反应)来探究“条件对化学反应速率的影响”并设计了如下的方案记录实验结果(忽略溶液混合体积变化)限选试剂和仪器:0.20mol/l KMnO4 溶液(酸性)蒸馏水、试管、量筒、秒表、恒温水浴槽
回答下列问题:
(1)完成上述反应原理的离子反应方程式
□MnO4-+□5H2C2O2+□6H+=□Mn2-+□CO2↑+□H2
(2)上述实验①②是温度探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则表格中“甲”应填写V(蒸馏水)/mL,a为1.0;乙是实验需要测量的物理量,则表格中“乙”应填
写溶液褪色的时间
(3)上述实验②④是探究催化剂对化学反应速率的影响,请在答题卷的坐标图1中画出②和④的能量变化关系图(做必要的标注)
Ⅱ某化学小组利用图2装置进行实验证明氧化性;KMnO4>Cl2>Br2,限选试剂:KBr溶液、KMnO4.浓盐酸、浓硫酸
(4)装置a、d中盛放的试剂分别是:浓盐酸、KBr溶液;试验中观察到的现象为c中有黄绿色气体产生,d中溶液变为棕黄色;此实验装置的不足之处是无尾气处理装置

| 物理量 编号 | V(0.20mol/L H2C2O4溶液)/mL | 甲 | V(O.O1mol/L KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 5.0 | |
| ② | 2.0 | 0 | 4.0 | 0 | 2.5 | |
| ③ | 1.0 | a | 4.0 | 0 | 2.5 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 2.5 |
(1)完成上述反应原理的离子反应方程式
□MnO4-+□5H2C2O2+□6H+=□Mn2-+□CO2↑+□H2
(2)上述实验①②是温度探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则表格中“甲”应填写V(蒸馏水)/mL,a为1.0;乙是实验需要测量的物理量,则表格中“乙”应填
写溶液褪色的时间
(3)上述实验②④是探究催化剂对化学反应速率的影响,请在答题卷的坐标图1中画出②和④的能量变化关系图(做必要的标注)
Ⅱ某化学小组利用图2装置进行实验证明氧化性;KMnO4>Cl2>Br2,限选试剂:KBr溶液、KMnO4.浓盐酸、浓硫酸
(4)装置a、d中盛放的试剂分别是:浓盐酸、KBr溶液;试验中观察到的现象为c中有黄绿色气体产生,d中溶液变为棕黄色;此实验装置的不足之处是无尾气处理装置

19.下表是25℃时几种酸的电离平衡常数,结合相关数据和所学知识分析下列说法,其中正确的是( )
| 酸 | CH3COOH | HCN | HF | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | 6.6×10-4 | Ka1=4.3×10-2Ka2=5.6×10-11 |
| A. | 5种钠盐溶液pH大小关系pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)>pH(NaF) | |
| B. | 2mol•L-1HCN与1mol•L-1NaOH溶液等体积混合后的溶液中:c(CN-)<c(Na+)<c(HCN) | |
| C. | 向Na2CO3溶液中滴加过量的HCN溶液;2HCN+Na2CO3=2NaCN+CO2↑+H2O | |
| D. | 含等物质的量的Na2CO3、NaHCO3的混合液中:2c(Na+)=3c(CO32-)+3C(HCO3-) |
16.关于反应 14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4下列说法正确的是( )
| A. | 该反应的氧化剂只有CuSO4 | |
| B. | SO42-既不是氧化产物也不是还原产物 | |
| C. | 1mol CuS04 还原了$\frac{1}{4}$mol S | |
| D. | 被还原的S和被氧化的S的质量比为7:3 |
3.当大量氯气泄漏时,用浸润下列某物质水溶液的毛巾捂住鼻子可防中毒.适宜的物质是( )
| A. | NaOH | B. | KI | C. | NH3 | D. | Na2CO3 |
13.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该硫酸的物质的量浓度为9.2 mol/L | |
| B. | 1 mol Zn与足量该硫酸反应产生2 g氢气 | |
| C. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L |
20.氮化硅是一种高温陶瓷材料,其硬度大、熔点高,下列晶体熔化(或升华)时所克服的微粒间作用力都与氮化硅相同的是( )
| A. | 白磷、硅 | B. | 碳化硅、硫酸钠 | C. | 水晶、金刚石 | D. | 碘、汞 |
17.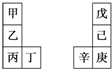 甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
 甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 丙与庚的原子序数相差3 | |
| B. | 气态氢化物的热稳定性:戊>己>庚 | |
| C. | 乙所在周期元素中,其简单离子的半径最大 | |
| D. | 乙的单质在空气中燃烧生成的化合物只含离子键 |
18.下列微粒可以大量共存于同一溶液中的是( )
| A. | NH4+、CH3COO-、Ca2+、Cl- | B. | Fe3+、Ag+、SO42-、NO3- | ||
| C. | Cu2+、H+、S2-、NO3- | D. | C6H5OH、Fe3+、K+、Cl- |