题目内容
3.①~⑩十种元素,在元素周期表中的位置如图所示.回答下列问题:
(1)在上述十种元素中,置换酸中氢的能力最强的元素为Na(填化学符号,下同);最高价氧化物的水化物的酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是NaOH,显两性的氢氧化物的化学式是Al(OH)3;原子半径最大的元素是Na,半径最小的离子是H+.
(2)上述十种元素中,金属性最强的元素在周期表中的位置是第三周期IA族,该元素的单质在空气中燃烧的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2.
(3)试用电子式表示元素①和③形成分子的过程
 .
.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为Na、⑤为Mg、⑥为Al、⑦为Si、⑧为P、⑨为Sr、⑩为Cl;
(1)周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强.同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱.金属性越强,与酸反应置换氢的能力越强,最高价氧化物的水化物的碱性越强,非金属性越强,最高价氧化物的水化物的酸性越强;
氢氧化铝是两性氢氧化物;
电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大;
(2)同周期自左而右金属性减弱、同主族自上而下金属性增强,故Na的金属性最强;钠在空气中燃烧生成过氧化钠;
(3)①和③形成分子为NH3,氨气是由极性键构成的共价化合物.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为Na、⑤为Mg、⑥为Al、⑦为Si、⑧为P、⑨为Sr、⑩为Cl;
(1)周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强.同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱.
上述元素中Na的金属性最强,与酸反应置换氢的能力最强,NaOH的碱性越强,非金属性越强,最高价氧化物的水化物的酸性越强,酸性最强的为HClO4;
Al(OH)3是两性氢氧化物;原子半径最大为Na;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故H+离子半径最小,
故答案为:Na;HClO4;NaOH;Al(OH)3;Na;H+;
(2)同周期自左而右金属性减弱、同主族自上而下金属性增强,故Na的金属性最强,处于第三周期IA族;钠在空气中燃烧生成过氧化钠,反应方程式为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,
故答案为:三、IA;2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;
(3)①和③形成分子为NH3,氨气是由极性键构成的共价化合物,用电子式表示形成过程为: ,
,
故答案为: .
.
点评 本题考查元素周期表的结构和元素周期律的应用,难度不大,侧重对基础知识的巩固.

 名校课堂系列答案
名校课堂系列答案| A. | 氯气 | B. | 二氧化硫 | C. | 活性炭 | D. | 硫化氢 |
| A. | 11.2 L氧气中所含有的原子数为NA | |
| B. | 7.8g的Na2O2中含有的阴离子的数目为0.2NA | |
| C. | 0.10mol Fe 粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 54g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |
| A. | 都易溶于水 | B. | 水溶液都显碱性 | C. | 都能与盐酸反应 | D. | 加热都能分解 |
| A. | 0.7g | B. | 1.1 g | ||
| C. | 2.2 g | D. | 在1.1g和2.2g之间 |
| A. | 氧气和臭氧互为同分异构体 | B. | 二氧化碳晶体中存在分子间作用力 | ||
| C. | 1H2O和2H2O互为同位素 | D. | 正丁烷和异丁烷互为同系物 |
| A. |  | B. | 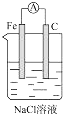 | C. |  | D. | 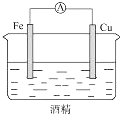 |
 将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示: 物质的结构决定性质,性质反映其结构特点.
物质的结构决定性质,性质反映其结构特点.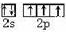 .
.