题目内容
15.下列说法中,正确的是( )| A. | 氧气和臭氧互为同分异构体 | B. | 二氧化碳晶体中存在分子间作用力 | ||
| C. | 1H2O和2H2O互为同位素 | D. | 正丁烷和异丁烷互为同系物 |
分析 A.具有相同分子式而结构不同的化合物互为同分异构体,同种元素形成的不同单质是同素异形体;
B.分子晶体存在分子间作用力;
C.具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;
D.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,具有相同分子式而结构不同的化合物互为同分异构体.
解答 解:A.同分异构体必须为化合物,氧气(O2)与臭氧(O3)都是由氧元素形成的不同单质,互为同素异形体,故A错误;
B.二氧化碳晶体是分子晶体,二氧化碳分子间存在分子间作用力,故B正确;
C.同位素指原子,1H2O和2H2O都是表示水分子,是同种物质,故C错误;
D.正丁烷CH3CH2CH2CH3,异丁烷CH3CH(CH3)CH3,分子式相同,结构不同,为碳链异构,互为同分异构体,故D错误;
故选B.
点评 本题考查同素异形体、分子间作用力、同位素、同系物、同分异构体的区别,题目难度不大,注意把握概念的内涵与外延.

练习册系列答案
相关题目
5.在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2CO2═2Na2CO3+O2 | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | NaOH+HNO3═NaNO3+H2O |
6.已知:
C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
H-H、O=O键能分别为436、496kJ•mol-1,则O-H键能为( )
C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ•mol-1
H-H、O=O键能分别为436、496kJ•mol-1,则O-H键能为( )
| A. | 222 kJ•mol-1 | B. | 444 kJ•mol-1 | C. | 462 kJ•mol-1 | D. | 924 kJ•mol-1 |
20.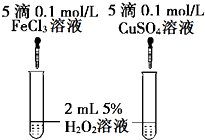 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
(1)该反应在这5min内的平均反应速率v(A2)=0.8 mol/(L•min).
(2)经过一段时间反应达到化学平衡状态,下列说法能充分说明该反应已达到化学平衡状态的是④.(填序号)
①A2、B2、AB3的浓度相等 ②正、逆反应速率均等于零
③A2、B2、AB3在容器中共存 ④A2、B2、AB3的浓度均不再改变
(3)下列条件不能改变该化学反应的限度的是④.(填序号)
①温度 ②浓度 ③压强 ④催化剂
(4)下列与改变化学反应速率无关的是③.(填序号)
①将食物存放在温度低的地方
②淀粉在淀粉酶的作用下发生水解反应
③铁粉与水蒸气的反应中,增加铁粉的用量
④将两种块状固体药品研细并混匀后再进行反应
(5)实验室可以利用稀硫酸与锌反应制取氢气.
①实验室用30%的稀硫酸溶液与锌粒反应制取氢气,反应进行一段时间后,气泡边得稀少了,锌粒还有剩余,再添加一些适当浓度的硫酸溶液到反应容器中,气泡又增多,其原因是浓度越大反应速率快.
②某学生为了探究锌与稀硫酸反应过程中速率变化.在100mL稀硫酸中加入足量的锌粉,标准状况下测得数据累计值如下:
在0~1、1~2、2~3、3~4、4~5min时间段中,反应速率最快的时间段是2~3min;0~5min内,化学反应速率变化的原因是H+浓度变小.
(6)经研究知Cu2+对H2O2分解具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学设计了如图甲、乙所示的实验.通过观察反应产生气泡的快慢,可定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
 一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.
一定温度下,2L的密闭容器中,发生反应:A2(g)+3B2(g)?2AB3(g).A2在5min内物质的量由12mol变成了4mol.(1)该反应在这5min内的平均反应速率v(A2)=0.8 mol/(L•min).
(2)经过一段时间反应达到化学平衡状态,下列说法能充分说明该反应已达到化学平衡状态的是④.(填序号)
①A2、B2、AB3的浓度相等 ②正、逆反应速率均等于零
③A2、B2、AB3在容器中共存 ④A2、B2、AB3的浓度均不再改变
(3)下列条件不能改变该化学反应的限度的是④.(填序号)
①温度 ②浓度 ③压强 ④催化剂
(4)下列与改变化学反应速率无关的是③.(填序号)
①将食物存放在温度低的地方
②淀粉在淀粉酶的作用下发生水解反应
③铁粉与水蒸气的反应中,增加铁粉的用量
④将两种块状固体药品研细并混匀后再进行反应
(5)实验室可以利用稀硫酸与锌反应制取氢气.
①实验室用30%的稀硫酸溶液与锌粒反应制取氢气,反应进行一段时间后,气泡边得稀少了,锌粒还有剩余,再添加一些适当浓度的硫酸溶液到反应容器中,气泡又增多,其原因是浓度越大反应速率快.
②某学生为了探究锌与稀硫酸反应过程中速率变化.在100mL稀硫酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(6)经研究知Cu2+对H2O2分解具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学设计了如图甲、乙所示的实验.通过观察反应产生气泡的快慢,可定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
7.对室温下100mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )


| A. | 加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 | |
| B. | 温度都升高20℃后,两溶液的pH不再相等 | |
| C. | 加水稀释至溶液体积为200 mL后,两种溶液中c(OH-)都减小 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气体积可用右图表示 |
4.下列有关化学用语的表述错误的是( )
| A. | Ca2+的结构示意图为: | |
| B. | 氯仿的化学式:CHCl3 | |
| C. | R2+离子核外有a个电子,b个中子,R原子表示为a+ba+b+2R | |
| D. | 溴化氢分子的电子式: |
5.“喷水溶液法”是最近日本科学家研究出的一种使沙漠变绿洲的新技术,它是在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土结合,在地表下30-50cm处形成0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截、蓄积雨水作用.下列对聚丙烯酸酯说法不正确的是( )
| A. | 形成它的小分子结构简式为CH2=CHCOOR(R为烃基) | |
| B. | 在一定条件下能发生加成反应 | |
| C. | 在一定条件下能发生水解反应 | |
| D. | 没有固定的熔沸点 |

 .
.


