题目内容
13.在A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成化合物,但常温时A、B形成的化合物呈液态,C、B形成的化合物呈固态,D的原子最外层电子数最多,E的核电荷数最大,D与E组成的ED4常温下为气态.(1)画出D的原子结构示意图
 ,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号);
,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号);(2)写出A与B可以形成2种化合物的结构式为H-O-O-H,H-O-H;
(3)由C与B原子形成的2种化合物的电子式分别是
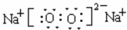 、
、 ;
;(4)D、E所形成氢化物的稳定性由强到弱的顺序是HF>SiH4 (填具体的化学式);
(5)由短周期元素组成的某些微粒,原子总数相同、价电子总数相同的分子(或离子)如SO2、O3、NO2-,可互称为等电子体,则与B、D同周期元素组成的微粒中,能与N3-、CS2互称为等电子体的微粒是二氧化碳,一氧化二氮 (填符合要求2种微粒的名称);
(6)写出工业上制E单质的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
分析 A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成的化合物,常温时A、B形成的化合物呈液态,C、B形成的化合物呈固态,则A为H元素、B为氧元素、C为Na元素;D的原子最外层电子数最多,E的核电荷数最大,D与E能形成气态物质ED4,则E为+4价,D为-1价,可推知E为Si元素、D为F元素,据此解答.
解答 解:A、B、C、D、E五种短周期主族元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成的化合物,常温时A、B形成的化合物呈液态,C、B形成的化合物呈固态,则A为H元素、B为氧元素、C为Na元素;D的原子最外层电子数最多,E的核电荷数最大,D与E能形成气态物质ED4,则E为+4价,D为-1价,可推知E为Si元素、D为F元素.
(1)D为F,原子结构示意图为 ,所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,五种元素原子半径从大到小的顺序是:Na>Si>O>F>H,
,所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,五种元素原子半径从大到小的顺序是:Na>Si>O>F>H,
故答案为: ;Na>Si>O>F>H;
;Na>Si>O>F>H;
(2)A与B形成的化合物为H2O2、H2O,结构式分别为:H-O-O-H、H-O-H,
故答案为:H-O-O-H、H-O-H;
(3)由C与B原子形成的2种化合物为Na2O2、Na2O,电子式分别是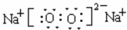 、
、 ,
,
故答案为: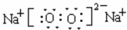 、
、 ;
;
(4)非金属性F>Si,非金属性越强,气态氢化物越稳定,氢化物的稳定性:HF>SiH4,
故答案为:HF>SiH4;
(5)则与O、F同周期元素组成的微粒中,能与N3-、CS2互称为等电子体的微粒是CO2、N2O等,
故答案为:二氧化碳、一氧化二氮;
(6)工业上制Si单质的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
点评 本题考查位置结构性质关系及应用,关键是根据物质组成推断元素,需要学生具备扎实的基础,题目难度中等.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案| A. |  干燥氯气 | B. |  检验K2CO3中的K+ | ||
| C. |  收集纯净的NH3并验满 | D. |  制备Fe(OH)2 |
| A. | 铝与稀盐酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
| A. | 68.3% | B. | 74.2% | C. | 92.2% | D. | 78.1% |
| A. | x-3 | B. | x+3 | C. | x+11 | D. | x-11 |
| A. | 乙烯在氧气中燃烧时放出热量,因此常用它来焊接或切割金属 | |
| B. | 乙二醇和丙三醇都是无色、黏稠、有甜味的液体,常用于配制化妆品 | |
| C. | 油脂在碱性条件下水解出的甘油常用于生产肥皂 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
| A. | NH3 | B. | 乙烯 | C. | 甲烷 | D. | 丙烯 |
| A. | 溶液中pH值不变,有H2放出 | B. | 液液中Na+数目减少,有O2放出 | ||
| C. | 溶液中pH值增大,有O2放出 | D. | 溶液中Na+浓度增大,有O2放出 |