题目内容
15.用下列实验装置完成对应的实验,操作正确并能达到实验目的是( )| A. |  干燥氯气 | B. |  检验K2CO3中的K+ | ||
| C. |  收集纯净的NH3并验满 | D. |  制备Fe(OH)2 |
分析 A.氯气和浓硫酸不反应,洗气装置中导气管应该遵循“长进短出”原则;
B.K元素焰色反应必须透过蓝色钴玻璃观察;
C.常温下氨气和氧气不反应,且氨气密度小于空气,可以采用向下排空气法收集氨气;
D.苯密度小于水,所以会浮在水上面,能隔绝空气.
解答 解:A.氯气和浓硫酸不反应,所以能用浓硫酸干燥氯气,但洗气装置中导气管应该遵循“长进短出”原则,故A错误;
B.K元素焰色反应必须透过蓝色钴玻璃观察,滤去黄光的干扰,故B错误;
C.常温下氨气和氧气不反应,且氨气密度小于空气,可以采用向下排空气法收集氨气,导气管应该伸入试管底部,故C错误;
D.苯密度小于水,所以会浮在水上面,能隔绝空气,防止氢氧化亚铁被氧化,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、焰色反应、气体收集、洗气等知识点,明确实验原理是解本题关键,易错选项是B,题目难度不大.

练习册系列答案
相关题目
6.下列解释实验事实的方程式正确的是( )
| A. | 常温下反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)的△H>0,△S<0 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g),△H=-38.6 kJ•mol-1 | |
| C. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| D. | 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5O-+CO2+H2O-→2C6H5OH↓+CO32- |
3.下表为元素周期表的一部分,请回答有关问题:
(1)⑥和⑧的元素符号分别是S、Ar;
(2)表中最活泼的金属是K,非金属最强的元素是F; (填写元素符号)
(3)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:在NaBr溶液中通入氯气(或加入氯水),溶液变红棕色(或橙色).
(4)比较③、④、⑨三种元素的金属性(或非金属性)强弱K>Mg>Al,判断的依据是(有反应方程式的请写涉及的化学方程式及必要的文字描述)2K+2H2O=2KOH+H2,剧烈反应,Mg+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2,缓慢反应,而金属铝与水在加热条件下反应不明显,结论:金属性K>Mg>Al.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属最强的元素是F; (填写元素符号)
(3)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:在NaBr溶液中通入氯气(或加入氯水),溶液变红棕色(或橙色).
(4)比较③、④、⑨三种元素的金属性(或非金属性)强弱K>Mg>Al,判断的依据是(有反应方程式的请写涉及的化学方程式及必要的文字描述)2K+2H2O=2KOH+H2,剧烈反应,Mg+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2,缓慢反应,而金属铝与水在加热条件下反应不明显,结论:金属性K>Mg>Al.
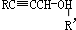
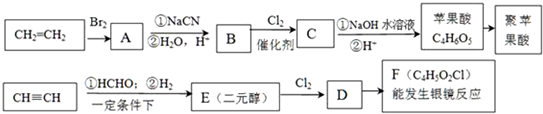
 .
.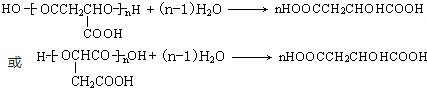 .
.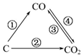 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视. ,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号);
,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号);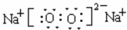 、
、 ;
;