题目内容
18.A、B为前三周期元素,两者组成A2B3型离子化合物,A离子比B离子少一个电子层,已知B的原子序数是x,则A的原子序数是( )| A. | x-3 | B. | x+3 | C. | x+11 | D. | x-11 |
分析 由两种短周期元素A和B形成的离子化合物A2B3,A3+离子比M2-离子少一个电子层,则A和M都属于第三周期,可推知A是Al元素,B是S元素,铝的原子序数是13,而硫是16号元素,由此分析解答.
解答 解:由两种短周期元素A和B形成的离子化合物A2B3,A3+离子比M2-离子少一个电子层,则A和M都属于第三周期,可推知A是Al元素,B是S元素,铝的原子序数是13,所以A的原子序数为16-3,即x-3,故选A.
点评 本题考查了元素位置结构性质的相互关系及应用,正确推断元素是解本题关键,结合原子、离子的结构来分析解答,难度中等.

练习册系列答案
相关题目
1.用一种试剂就能鉴别出乙醇、乙酸、甲酸和葡萄糖四种有机物的水溶液,该试剂是( )
| A. | 银氨溶液 | B. | 金属钠 | ||
| C. | FeCl3溶液 | D. | 新制的Cu(OH)2碱性悬浊液 |
6.有A、B两种烃,其相关信息如下:
回答下列问题:
(1)烃A的实验式是CH;
(2)烃A的结构简式是 ;
;
(3)烃B的三种二溴代物的结构简式为CHBr2CH(CH3)2、CH2BrCBr(CH3)2、CH2BrCH(CH3)CH2Br;
(4)烃C为烃B的同系物,常温下为气态且只有一种一溴代物,则烃C的一溴代物的结构简式为CH3Br或CH3CH2Br或(CH3)3CCH2Br(填一种即可).
| A | ①完全燃烧的产物中n(CO2):n(H2O)=2:1 ②28<M (A)<60 ③不能使溴的四氯化碳溶液褪色 ④一氯代物只有一种结构 |
| B | ①饱和链烃,通常情况下呈气态 ②有同分异构体 ③二溴代物有三种 |
(1)烃A的实验式是CH;
(2)烃A的结构简式是
 ;
;(3)烃B的三种二溴代物的结构简式为CHBr2CH(CH3)2、CH2BrCBr(CH3)2、CH2BrCH(CH3)CH2Br;
(4)烃C为烃B的同系物,常温下为气态且只有一种一溴代物,则烃C的一溴代物的结构简式为CH3Br或CH3CH2Br或(CH3)3CCH2Br(填一种即可).
3.下列反应的离子方程式书写正确的是( )
| A. | 氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2Cl- | |
| B. | 大理石和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液和稀硝酸反应:HCO3-+H+═H2↑+CO32- | |
| D. | 盐酸和氢氧化钾溶液反应:H++OH-═H2O |
10.下列物质中,属于电解质的是( )
| A. | Cl2 | B. | NaNO3 | C. | SO2 | D. | 硫酸溶液 |
8.相同体积,相同物质的量浓度的CuSO4、Al2(SO4)3两种溶液,若将上述两种溶液中SO42-完全沉淀,所用相同物质的量浓度的BaCl2溶液体积比为( )
| A. | 2:3 | B. | 3:1 | C. | 1:3 | D. | 3:2 |
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视. ,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号);
,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号);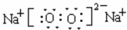 、
、 ;
;