题目内容
2.下列气体的收集用错装置的是( )| A. | 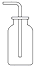 Cl2的收集 | B. | 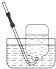 HCl的收集 | C. |  NH3的收集 | D. | 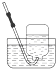 NO的收集 |
分析 A.氯气的密度大于空气,需要使用向上排空气法收集;
B.氯化氢极易溶于水,不能使用排水法收集;
C.氨气的密度小空气,需要用向下排空气法收集;
D.一氧化氮能够与空气中的氧气反应,需要用排水法收集.
解答 解:A.氯气的密度比空气大,需要用向上排空气法收集,该收集方法合理,故A正确;
B.氯化氢极易溶于水,不能用排水法收集,应该使用向上排空气法收集,故B错误;
C.氨气有毒,且密度小于空气,需要用向下排空气法收集,且试管口塞一团棉花,该装置合理,故C正确;
D.NO与氧气反应,不能使用排空气法收集,可以使用排水法收集,故D正确;
故选B.
点评 本题考查了常见气体的收集方法判断,题目难度中等,明确常见气体的性质为解答关键,注意熟练掌握常见气体的收集方法,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12. 25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
mol•L-1NaOH溶液,溶液pH变化如图所示.此过程中
下列说法正确的是(溶液混合忽略体积变化)( )
 25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1 mol•L-1NaOH溶液,溶液pH变化如图所示.此过程中
下列说法正确的是(溶液混合忽略体积变化)( )
| A. | a点:c(CH3COO-)<c(Na+) | |
| B. | 水的电离程度:c点小于d点 | |
| C. | b点时,NaoH和CH3COOH恰好完全反应 | |
| D. | d点:c(OH-)-c(H+)+c(CH3COOH)=0.2 mol•L-1 |
13.已知阴离子X n-含有N个中子,元素X的质量数为A,则a g Xn- 中含电子的物质的量是( )
| A. | $\frac{A-N-n}{aA}$ mol | B. | $\frac{a(A-N)}{A}$ mol | C. | $\frac{m(A-N-n)}{A}$ mol | D. | $\frac{a(A-N+n)}{A}$ mol |
10.下列说法中不正确的是( )
| A. | 一定温度下,反应2Mg(s)+CO2(g)=2MgO(s)+C(s)能自发进行,则该反应△H<0 | |
| B. | 使用催化剂,降低反应的活化能,增大单位体积内活化分子百分数,反应速率增大 | |
| C. | SO2(g)+2CO(g)?2CO2(g)+S(l)达到平衡,保持其他条件不变,分离出硫,正反应速率加快,SO2的转化率提高 | |
| D. | 恒温恒压下,向一平衡体系中通入惰性气体,反应速率减小 |
17. (1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:
(1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
该反应的平衡常数表达式K=$\frac{[C{O}_{2}]}{[CO]}$,△H<0(填“>”、“<”或“=”);
(2)工业上CO 也用于合成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1.一定压强下,向容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示.
①p1小于p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=$(\frac{V}{a})^{2}$(mol•L-1)-2;
③保持其它条件不变,下列措施中能够增大上述合成甲醇反应的反应速率、且能提高CO转化率的是cd.(填字母).
a.使用高效催化剂 b.降低反应温度 c.通入H2d.再增加a mol CO和2a molH2 e.不断将CH3OH从反应混合物中分离出来.
 (1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:
(1)CO是高炉炼铁的主要反应物之一,发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)工业上CO 也用于合成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1.一定压强下,向容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示.
①p1小于p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=$(\frac{V}{a})^{2}$(mol•L-1)-2;
③保持其它条件不变,下列措施中能够增大上述合成甲醇反应的反应速率、且能提高CO转化率的是cd.(填字母).
a.使用高效催化剂 b.降低反应温度 c.通入H2d.再增加a mol CO和2a molH2 e.不断将CH3OH从反应混合物中分离出来.
7.形成节约能源和保护生态环境的产业结构是人类与自然和谐发展的重要保证,你认为下列行为中有悖于这一保证的是( )
| A. | 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 | |
| B. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| C. | 在农村推广使用沼气 | |
| D. | 减少资源消耗、增加资源的重复使用和资源的循环再生 |
11.下列有关热化学方程式的叙述正确的是( )
| A. | 已知甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 已知中和热为△H=-57.4 kJ•mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 | |
| D. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 |
 合成氨是人类科学技术上的一项重大突破,其反应原理为:
合成氨是人类科学技术上的一项重大突破,其反应原理为: