题目内容
12. 25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1 mol•L-1NaOH溶液,溶液pH变化如图所示.此过程中
下列说法正确的是(溶液混合忽略体积变化)( )
| A. | a点:c(CH3COO-)<c(Na+) | |
| B. | 水的电离程度:c点小于d点 | |
| C. | b点时,NaoH和CH3COOH恰好完全反应 | |
| D. | d点:c(OH-)-c(H+)+c(CH3COOH)=0.2 mol•L-1 |
分析 A.a点溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性;
B.氢氧根离子浓度越大对水的电离平衡抑制程度越大;
C.c点两者恰好完全反应;
D.根据电荷守恒和物料守恒分析.
解答 解:A.a点时醋酸过量,溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,应存在c(CH3COO-)>c(Na+),故A错误;
B.氢氧根离子浓度越大对水的电离平衡抑制程度越大,而d点氢氧化钠的浓度大于c点,所以c点氢氧化钠浓度小于d点,所以水的电离程度:c点大于d点,故B错误;
C.20mL0.1 mol•L-1醋酸溶液中不断滴入20mL0.1 mol•L-1NaOH溶液,两者恰好完全反应,所以c点时恰好完全反应,故C错误;
D.根据溶液电荷守恒可知溶液中应存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒可知2c(Na+)=3c(CH3COO-)+3c(CH3COOH),由此可得:c(OH-)-c(H+)+c(CH3COOH)=$\frac{1}{2}$c(Na+)=0.2 mol•L-1,故D正确;
故选D.
点评 本题考查酸碱混合的判断和离子浓度大小比较,答题时注意a、b、c、d点溶液的组成,把握弱电解质的电离和盐类水解的特点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列有关金属的说法中,不正确的是( )
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝是活泼金属,但在空气中耐腐蚀 | |
| C. | MgO可以与Al组成铝热剂,进行铝热反应 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
7.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | NA个氢氧化铁胶粒的质量为107g | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 在50g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 在密闭容器中,0.5molH2和0.5molN2充分反应后得不到NA个NH3分子 |
17.将一定量的Cl2通入30mL10.00 mol•L-1的浓KOH溶液中,适当加热使溶液中形成KCl、KClO、KClO3共存体系,下列有关说法错误的是 ( )
| A. | 溶液中n(KCl)=n(KClO)+5n(KClO3) | |
| B. | 参加反应的氯气的物质的量一定为0.15mol | |
| C. | 若反应中转移电子为nmol,则0.15mol<n<0.25mol | |
| D. | 共存体系溶液中,n(K+)、n(Cl-)可能为7:3 |
1.下列各组物质的性质及粒子的性质变化正确的是( )
| A. | 稳定性H2S>HCl>HBr>HI | B. | 酸性HF>HCl>HBr>HI | ||
| C. | 离子半径K+>Cl->S2->S | D. | 酸性HClO4>H2SO4>H2CO3>HClO |
2.下列气体的收集用错装置的是( )
| A. |  Cl2的收集 | B. | 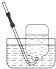 HCl的收集 | C. |  NH3的收集 | D. |  NO的收集 |