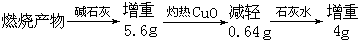题目内容
13.已知阴离子X n-含有N个中子,元素X的质量数为A,则a g Xn- 中含电子的物质的量是( )| A. | $\frac{A-N-n}{aA}$ mol | B. | $\frac{a(A-N)}{A}$ mol | C. | $\frac{m(A-N-n)}{A}$ mol | D. | $\frac{a(A-N+n)}{A}$ mol |
分析 根据n=$\frac{m}{M}$,先利用质量和质量数计算原子的物质的量,质量数=质子数+中子数,再由阴离子Xn-核外有N个中子,则质子数为A-N,阴离子中,质子数+所带电荷数=核外电子数,电子数为A-N+n,以此解答该题.
解答 解:元素X的质量数为A,则ag Xn-物质的量为$\frac{ag}{Ag/mol}$=$\frac{a}{A}$mol,质量数=质子数+中子数,阴离子Xn-核外有N个中子,则质子数为A-N,阴离子中,质子数+所带电荷数=核外电子数,电子数为A-N+n,则agXn-电子的物质的量为$\frac{a}{A}(A-N+n)$mol,
故选D.
点评 本题考查学生利用原子构成的简单计算,明确原子的物质的量的计算是解答本题的关键,注意电子的质量可忽略,质量数近似等于相对原子质量,题目难度不大.

练习册系列答案
相关题目
3.下列有关金属的说法中,不正确的是( )
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝是活泼金属,但在空气中耐腐蚀 | |
| C. | MgO可以与Al组成铝热剂,进行铝热反应 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
1.下列各组物质的性质及粒子的性质变化正确的是( )
| A. | 稳定性H2S>HCl>HBr>HI | B. | 酸性HF>HCl>HBr>HI | ||
| C. | 离子半径K+>Cl->S2->S | D. | 酸性HClO4>H2SO4>H2CO3>HClO |
8.下列物质中,所含化学键类型完全相同的是( )
| A. | CaCl2 K2S | B. | CO2 Na2O2 | C. | NaOH HCl | D. | NH4Cl CaH2 |
18.等质量的铜片在酒精灯上加热后,分别插入下列液体中,放置片刻后取出,铜片质量增加的是( )
| A. | 盐酸 | B. | 无水乙醇 | C. | 稀硝酸 | D. | NaOH溶液 |
5.下列物质充分反应后,滴入KSCN溶液,显红色的是( )
| A. | FeO+HNO3(溶液) | B. | 过量铁+稀硫酸 | ||
| C. | FeCl3(溶液)+过量铁 | D. | Fe+CuSO4(溶液) |
2.下列气体的收集用错装置的是( )
| A. |  Cl2的收集 | B. |  HCl的收集 | C. |  NH3的收集 | D. |  NO的收集 |
3.下列说法不正确的是( )
| A. | 元素周期表中,除第一和第七周期外,第n周期所含非金属元素的种数均为(8-n) | |
| B. | SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构 | |
| C. | 气态氢化物的水溶液都是酸 | |
| D. | ⅠA族和ⅥA族元素形成的原子个数比1:1、电子总数38的化合物,是有共价键的离子化合物 |