题目内容
元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是( )
| A、11和16 | B、6和8 |
| C、13和17 | D、20和9 |
考点:离子化合物的结构特征与性质
专题:化学键与晶体结构
分析:元素X、Y可组成化学式为XY2的离子化合物,说明X是较活泼的金属、Y是较不活泼的非金属,X化合价为+2价、Y化合价为-1价,则X位于第IIA族、Y位于第VIIA族,据此分析解答.
解答:
解:元素X、Y可组成化学式为XY2的离子化合物,说明X是较活泼的金属、Y是较不活泼的非金属,X化合价为+2价、Y化合价为-1价,则X位于第IIA族、Y位于第VIIA族,
A.11号元素位于第IA族、16号元素位于第VIA族,不符合条件,故A错误;
B.6号元素位于第IVA族、8号元素位于第VIA族,二者能形成共价化合物,不能形成离子化合物,故B错误;
C.13号元素位于第IIIA族、17号元素位于第VIIA族,二者形成共价化合物,故C错误;
D.20号元素位于第IIA族、9号元素位于第VIIA族,符合条件,故D正确;
故选D.
A.11号元素位于第IA族、16号元素位于第VIA族,不符合条件,故A错误;
B.6号元素位于第IVA族、8号元素位于第VIA族,二者能形成共价化合物,不能形成离子化合物,故B错误;
C.13号元素位于第IIIA族、17号元素位于第VIIA族,二者形成共价化合物,故C错误;
D.20号元素位于第IIA族、9号元素位于第VIIA族,符合条件,故D正确;
故选D.
点评:本题考查了离子化合物的判断,根据元素化合价确定元素在周期表中的位置,注意:非金属元素之间易形成共价键,氯化铝为共价化合物,为易错点.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
下列离子方程式与所述事实相符且正确的是( )
| A、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | ||||
| B、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | ||||
| C、向含有0.4mol FeBr2的溶液中通入0.3mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | ||||
D、以铜为电极电解饱和食盐水:2Cl-+2H2O
|
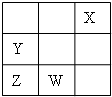 W、X、Y、Z为短周期元素,在周期表中位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )
W、X、Y、Z为短周期元素,在周期表中位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )| A、通常情况下四种元素的单质中,X化学性质最稳定 |
| B、四种元素都能与氢元素形成稳定的化合物 |
| C、Y、Z离子最外层电子数相同 |
| D、四种元素中Z元素最高价氧化物对应的水化物酸性最强 |
化学与科学、技术、社会、环境密切相关.下列叙述正确的是:①NO2、CO2和SO2都是大气污染物;②为了防止食品受潮变质,常在食品包装袋中放入活性铁粉;③单质硅是将太阳能转变为电能的常用材料;④维生素C易失电子,在人体内起抗氧化作用( )
| A、①② | B、②③ | C、③④ | D、①④ |
苯环结构中不存在C-C单键与C=C双键的交替结构,可以作为证据的是( )
①苯不能使溴水反应褪色
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤苯是正六边形.
①苯不能使溴水反应褪色
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤苯是正六边形.
| A、①②④⑤ | B、①③④⑤ |
| C、①②③④ | D、②③④⑤ |
对于常温下0.01mol/L的氨水,下列叙述正确的是( )
| A、c(H+)+c(NH4+)=2c(OH-) |
| B、由H2O电离出的c(H+)=1.0×10-12mol?L-1 |
| C、与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3?H2O)+c(NH3)=0.02mol?L-1 |
| D、与等体积等浓度的盐酸混合后所得溶液c(OH-)+c(NH3?H2O)+c(NH3)=c(H+) |
有等体积的NaCl、CaCl2、AlCl3溶液,完全沉淀其中的Cl-消耗同浓度的AgNO3溶液体积相等,则三种溶质的浓度之比为( )
| A、1:1:1 |
| B、1:2:3 |
| C、6:3:2 |
| D、3:2:1 |
在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
| A、Na2CO3和Na2O2 |
| B、Na2CO3和NaOH |
| C、NaOH和Na2O2 |
| D、NaOH、Na2O2和Na2CO3 |