题目内容
有等体积的NaCl、CaCl2、AlCl3溶液,完全沉淀其中的Cl-消耗同浓度的AgNO3溶液体积相等,则三种溶质的浓度之比为( )
| A、1:1:1 |
| B、1:2:3 |
| C、6:3:2 |
| D、3:2:1 |
考点:物质的量浓度的相关计算,离子方程式的有关计算
专题:物质的量浓度和溶解度专题
分析:根据消耗等物质的量的AgNO3,可知NaCl、CaCl2、AlCl3三种溶液中含氯离子的物质的量相同,假设n(Cl-)=1mol,根据化学式计算NaCl、CaCl2、AlCl3的物质的量,进而计算物质的量浓度之比.
解答:
解:分别加入足量的硝酸银溶液,Cl-沉淀完全时,消耗等物质的量的AgNO3,可知NaCl、CaCl2、AlCl3三种溶液中含氯离子的物质的量相同,假设n(Cl-)=1mol,根据物质的化学式可知:
n(NaCl)=1mol,n(CaCl2)=0.5mol,n(AlCl3)=
mol,
溶液的体积相同,则物质的量之比等于物质的量浓度之比,所以,三种溶液的物质的量浓度之比为:c(NaCl):c(MgCl2):c(AlCl3)=1:0.5:
=6:3:2,
故选C.
n(NaCl)=1mol,n(CaCl2)=0.5mol,n(AlCl3)=
| 1 |
| 3 |
溶液的体积相同,则物质的量之比等于物质的量浓度之比,所以,三种溶液的物质的量浓度之比为:c(NaCl):c(MgCl2):c(AlCl3)=1:0.5:
| 1 |
| 3 |
故选C.
点评:本题考查物质的量浓度有关计算,关键是确定氯离子物质的量相等,利用赋值法计算解答,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
1g氢气燃烧生成液态水放出142.9kJ的热量,表示该反应的热化学方程式正确的是( )
| A、2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ?mol-1 | ||
B、H2(g)+
| ||
| C、2H2+O2═2H2O△H=571.6 kJ?mol-1 | ||
D、H2(g)+
|
元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是( )
| A、11和16 | B、6和8 |
| C、13和17 | D、20和9 |
下列反应属于取代反应的是( )
A、CH2=CH2+H2O
| |||
B、2CH3CH2OH+O2
| |||
C、nCH2=CH2
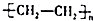 | |||
D、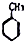 +3HNO3 +3HNO3
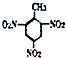 +3H2O +3H2O |
在由水电离出的c(H+)=1×10-13mol/L的溶液中,一定可以大量共存的是( )
| A、Ba2+Na+ NO3-Cl- |
| B、Fe2+ Na+ NO3- Cl- |
| C、SO42-SO32- NH4+Na+ |
| D、Mg2+Na+Br-AlO2- |
已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,A
B
C
D且D为强电解质(其它相关物质可能省略)下列说法不正确的是( )
| O2 |
| O2 |
| H2O |
| A、若A为非金属单质,则它与Mg反应的产物,其阴阳离子个数比可能为2:3 |
| B、若A为非金属单质,则其元素在周期表中的位置可能处于第二周期第IVA族 |
| C、不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下都能使铁和铝发生钝化 |
| D、若A是共价化合物,O.1mol的A分子中含有的电子数可能为NA(NA为阿佛加德罗常数的值) |
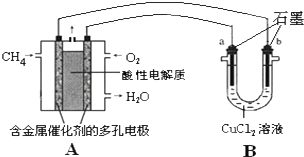 (1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染.
(1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染.