题目内容
对于常温下0.01mol/L的氨水,下列叙述正确的是( )
| A、c(H+)+c(NH4+)=2c(OH-) |
| B、由H2O电离出的c(H+)=1.0×10-12mol?L-1 |
| C、与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3?H2O)+c(NH3)=0.02mol?L-1 |
| D、与等体积等浓度的盐酸混合后所得溶液c(OH-)+c(NH3?H2O)+c(NH3)=c(H+) |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.根据电荷守恒判断;
B.碱或酸抑制水电离,根据溶液的pH、水的离子积常数计算水电离出的c(H+);
C.混合溶液中存在物料守恒;
D.等物质的量是氨水和盐酸恰好反应生成氯化铵,结合物料守恒和电荷生成判断.
B.碱或酸抑制水电离,根据溶液的pH、水的离子积常数计算水电离出的c(H+);
C.混合溶液中存在物料守恒;
D.等物质的量是氨水和盐酸恰好反应生成氯化铵,结合物料守恒和电荷生成判断.
解答:
解;A.溶液中存在电荷守恒,即c(H+)+c(NH4+)=c(OH-),故A错误;
B.假设氨水是强碱,0.0l mol/L的氨水中c(OH-)=0.01mol/L,则溶液的pH=12,溶液中氢离子全部来自于水电离的,所以由H2O电离出的c (H+)=1.0×10-12mol?L-1,实际上,氨水是弱碱,所以由H2O电离出的c (H+)>1.0×10-12mol?L-1,故B错误;
C.等体积混合物后浓度都为原来的一半,根据物料守恒得c(NH4+)+c(NH3?H2O)+c(NH3)=0.01mol?L-1,故C错误;
D.等物质的量是氨水和盐酸恰好反应生成氯化铵,由物料守恒可知c(NH4+)+c (NH3?H2O)+c(NH3)=c(Cl-),由电荷生成可知,c(OH-)+c(Cl-)=c(NH4+)+c (H+),二者联式可得c(OH-)+c(NH3?H2O)+c(NH3)=c(H+),故D正确.
故选D.
B.假设氨水是强碱,0.0l mol/L的氨水中c(OH-)=0.01mol/L,则溶液的pH=12,溶液中氢离子全部来自于水电离的,所以由H2O电离出的c (H+)=1.0×10-12mol?L-1,实际上,氨水是弱碱,所以由H2O电离出的c (H+)>1.0×10-12mol?L-1,故B错误;
C.等体积混合物后浓度都为原来的一半,根据物料守恒得c(NH4+)+c(NH3?H2O)+c(NH3)=0.01mol?L-1,故C错误;
D.等物质的量是氨水和盐酸恰好反应生成氯化铵,由物料守恒可知c(NH4+)+c (NH3?H2O)+c(NH3)=c(Cl-),由电荷生成可知,c(OH-)+c(Cl-)=c(NH4+)+c (H+),二者联式可得c(OH-)+c(NH3?H2O)+c(NH3)=c(H+),故D正确.
故选D.
点评:本题考查酸碱混合时离子浓度大小的比较等知识点,侧重于学生的分析能力的考查,为高考常见题型,易错选项是C,注意两种溶液混合时,浓度变为原来的一半,为易错点,难度中等.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
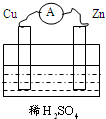 如图将Cu、Zn两种金属片插入稀H2SO4中,构成铜锌原电池,下列关于铜锌原电池的叙述正确的是( )
如图将Cu、Zn两种金属片插入稀H2SO4中,构成铜锌原电池,下列关于铜锌原电池的叙述正确的是( )| A、溶液中的H+向负极移动 |
| B、Zn片作负极,发生还原反应 |
| C、溶液的PH值将增大 |
| D、电子从Cu流出经导线流向Zn |
甲基环己烷可由甲苯与氢气加成制得,其环上一氯代物的同分异构体数目是( )
| A、4 | B、3 | C、2 | D、1 |
化学与科技、社会、生产密切结合,下列有关说法正确的是( )
| A、“纯净水”清洁、纯净,长期饮用有益健康 |
| B、维生素C不宜与含硫酸亚铁的补血剂同服 |
| C、在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| D、味觉上具有酸味的食物即酸性食物,长期食用会导致血液偏酸性,引起缺钙 |
元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是( )
| A、11和16 | B、6和8 |
| C、13和17 | D、20和9 |
下列原理或操作不正确的是( )
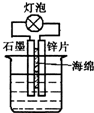

| A、在如图装置的稀硫酸中加入适量重铬酸钾或适量6%的H2O2溶液,可以使灯泡亮度增大,持续时间变长 |
| B、纸层析法分离微量成份时均需有以下流程:装置制作→点层析试样→配制展开剂→层析操作→显色反应 |
| C、在提纯混有少量NaCl的KNO3时,常先将混合物在较高温度下溶于水形成浓溶液,再经过冷却结晶、过滤、洗涤、干燥,获得KNO3晶体 |
| D、制摩尔盐时用酒精洗涤产品,用干净的滤纸吸干;而在制阿司匹林粗品时用冷水洗涤产品,在空气中风干 |
在由水电离出的c(H+)=1×10-13mol/L的溶液中,一定可以大量共存的是( )
| A、Ba2+Na+ NO3-Cl- |
| B、Fe2+ Na+ NO3- Cl- |
| C、SO42-SO32- NH4+Na+ |
| D、Mg2+Na+Br-AlO2- |
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、46g有机物C2H6O中含有的H-O键的数目为NA |
| B、常温下,2L 1mol?L-1的乙酸溶液中,所含分子总数小于2NA |
| C、标准状况下,5.6L NO和5.6L O2组成的混合气体中所含原子数为NA |
| D、18g D2O含有的电子总数为10NA |