题目内容
9.乙烷和丙烷的混合气体完全燃烧后,先将产物通过浓硫酸,浓硫酸增重2.04g,然后通过Na2O2 ,Na2O2 增重2.24g,混合气体中乙烷和丙烷的体积比为( )| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:5 |
分析 浓硫酸增重为燃烧生成水的质量,通过过氧化钠发生反应:2CO2+2Na2O2=2Na2CO3+O2,固体质量增重等于与二氧化碳等物质的量的CO的质量,设乙烷、丙烷的物质的量分别为xmol、ymol,根据C、H原子守恒列方程计算解答.
解答 解:浓硫酸增重为燃烧生成水的质量,即混合物反应生成了2.04g;
二氧化碳与过氧化钠发生反应:2CO2+2Na2O2=2Na2CO3+O2,固体质量增重等于与二氧化碳等物质的量的CO的质量,故CO的物质的量=$\frac{2.24g}{28g/mol}$=0.08mol,
设乙烷、丙烷的物质的量分别为xmol、ymol,由H原子守恒及C原子守恒,则:
6x+8y=$\frac{2.04g}{18g/mol}$×2、2x+3y=0.08,
联立解得:x=0.02、y=$\frac{2}{150}$,
所以乙烷和丙烷的物质的量之比为:0.02mol:$\frac{2}{150}$mol=3:2,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,解答关键是根据方程式确定固体质量增重,注意利用原子守恒进行解答,有利于培养学生的逻辑推理能力,有助于提高学生的化学计算能力.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
19.下列各组物质中分子、离子或晶体的空间结构完全不同的是( )
| A. | NH3和H3O+ | B. | NH4+和CH4 | C. | CO2和SiO2 | D. | 金刚石和晶体硅 |
20.下列关于氯水的叙述中,正确的是( )
| A. | 新制氯水中只含Cl2和H2O两种分子 | |
| B. | 新制氯水可使紫色石蕊溶液先变红后褪色 | |
| C. | 久置的氯水pH增大,酸性增强 | |
| D. | 氯水经光照有气泡逸出,该气体是Cl2 |
17.下列有关元素周期表的说法正确的是( )
| A. | 元素周期表有8个主族 | B. | 0族原子的最外层电子数均为8 | ||
| C. | ⅠA族的元素全是金属元素 | D. | 短周期是指第1、2、3周期 |
14.向氯化钡溶液中通二氧化硫气体,未见沉淀出现,但若在此溶液中再加入少量的某种物质,立即出现白色沉淀,该物质不可能是( )
| A. | 氨水 | B. | 氢氧化钠 | C. | 酸性高锰酸钾 | D. | 盐酸 |
1.某无色透明的溶液中含有Cu2+、Mg2+、A13+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-中的三种离子,若向其中加入石蕊试液,溶液显蓝色;则原溶液中可能存在的离子是( )
| A. | Ba2+、OH-、NO3- | B. | Cu2+、HCO3-、NO3- | C. | Mg2+、A13+、SO42- | D. | Mg2+、SO42-、OH- |
2.对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得.
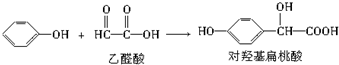
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A. | 上述反应的原子利用率可达到100% | |
| B. | 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰 | |
| C. | 对羟基扁桃酸可以发生加成反应、取代反应. | |
| D. | 1 mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH |