题目内容
14.向氯化钡溶液中通二氧化硫气体,未见沉淀出现,但若在此溶液中再加入少量的某种物质,立即出现白色沉淀,该物质不可能是( )| A. | 氨水 | B. | 氢氧化钠 | C. | 酸性高锰酸钾 | D. | 盐酸 |
分析 亚硫酸酸性小于盐酸,所以二氧化硫和氯化钡溶液不反应,但二氧化硫具有还原性,能被强氧化性物质氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,如果在此溶液中再加入少量的某种物质,立即出现白色沉淀,说明加入的少量物质具有强氧化性或能和二氧化硫反应生成亚硫酸根离子,据此分析解答.
解答 解:亚硫酸酸性小于盐酸,所以二氧化硫和氯化钡溶液不反应,但二氧化硫具有还原性,能被强氧化性物质氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,如果在此溶液中再加入少量的某种物质,立即出现白色沉淀,说明加入的少量物质具有强氧化性或能和二氧化硫反应生成亚硫酸根离子,
A.一水合氨和二氧化硫反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应而生成白色沉淀,故A不选;
B.NaOH和二氧化硫反应生成亚硫酸钠,亚硫酸钠和氯化钡发生复分解反应而生成白色沉淀,故B不选;
C.高锰酸钾溶液具有强氧化性,能将二氧化硫氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,故C不选;
D.稀盐酸和二氧化硫不反应,所以加入稀盐酸没有沉淀生成,故D选;
故选D.
点评 本题以二氧化硫为载体考查氧化还原反应、复分解反应等知识点,侧重考查学生分析判断能力,明确复分解反应条件及元素化合物性质即可解答,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
4.下列表示物质变化的化学用语正确的是( )
| A. | 已知在298K时下述反应的有关数据:C(s)+$\frac{1}{2}$ O2(g)═CO(g)△H1=-110.5 kJ•mol-1C(s)+O2(g)═CO2(g)△H2=-393.5 kJ•mol-1,则C(s)+CO2(g)═2CO(g)△H=-172.5 kJ•mol-1 | |
| B. | KI溶液中滴加过量氯水发生反应的离子方程式为3Cl2+I-+3H2O═6H++IO3-+6Cl- | |
| C. | 等物质的量的NH4HCO3与Ba(OH)2 溶液混合反应的离子方程式为Ba2++HCO3-+OH-═BaCO3↓+H2O | |
| D. | 用铜作电极电解硫酸溶液:2H2O$\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2↑ |
2.某混合物气体中各气体的质量分数为O2 32%、N2 28%、CO2 22%、CH4 16%、H2 2%,则此混合气体对氢气的相对密度为( )
| A. | 11.11 | B. | 22.22 | C. | 30.00 | D. | 32.00 |
9.乙烷和丙烷的混合气体完全燃烧后,先将产物通过浓硫酸,浓硫酸增重2.04g,然后通过Na2O2 ,Na2O2 增重2.24g,混合气体中乙烷和丙烷的体积比为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:5 |
2.已知某反应的能量变化如图所示,下列说法正确的是( )


| A. | 该反应为放热反应 | |
| B. | 该反应可为Ba(OH)2•8H2O与NH4Cl晶体的反应 | |
| C. | 该反应可为甲烷在氧气中的燃烧反应 | |
| D. | 该反应只有在加热条件下才能进行 |
6.石灰石、生石灰和熟石灰均是重要的化工原料,下列工业生产中,可能用到上述原料的是( )
①炼铁 ②炼钢 ③从海水中提取镁 ④铝的冶炼⑤制水泥 ⑥制玻璃 ⑦制漂白粉 ⑧烧制陶瓷.
①炼铁 ②炼钢 ③从海水中提取镁 ④铝的冶炼⑤制水泥 ⑥制玻璃 ⑦制漂白粉 ⑧烧制陶瓷.
| A. | ①②⑤⑥⑦⑧ | B. | ③④⑤⑥⑦⑧ | C. | ①②③⑤⑥⑦ | D. | 全部 |
7.下列各组物质中,只用溴水就能鉴别的一组是( )
| A. | 己烯、苯、苯酚 | B. | 四氯化碳、硝基苯、乙醇 | ||
| C. | 乙酸、乙醇、苯酚 | D. | 乙烷、乙烯、乙炔 |
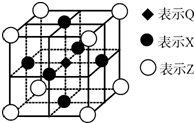 已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列.
已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列.