题目内容
20.下列关于氯水的叙述中,正确的是( )| A. | 新制氯水中只含Cl2和H2O两种分子 | |
| B. | 新制氯水可使紫色石蕊溶液先变红后褪色 | |
| C. | 久置的氯水pH增大,酸性增强 | |
| D. | 氯水经光照有气泡逸出,该气体是Cl2 |
分析 氯气与水发生:Cl2+H2O=HCl+HClO,HClO具有弱酸性、强氧化性、漂白性以及不稳定性,氯水中含有Cl2、HClO和H2O等分子,以此来解答.
解答 解:A、新制氯水中含有Cl2和H2O、HClO三种分子,故A错误;
B、新制氯水中含盐酸、HClO,可使紫色石蕊溶液先变红后褪色,故B正确;
C、新制氯水放置数天后,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,酸性增强,pH减小,故C错误;
D、光照新制氯水有气泡逸出,发生2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,该气体是O2,故D错误;
故选B.
点评 本题考查氯水的成分及性质,为高频考点,把握氯气与水的反应、HClO的性质为解答的关键,本题注意基础知识的积累和学习,题目难度不大.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 需要加热的化学反应都是不自发反应 | |
| B. | 中和反应都是放热反应 | |
| C. | 原电池是将电能转化为化学能的一种装置 | |
| D. | 太阳能电池是将化学能转化为电能的过程 |
11.下列说法中错误的是( )
| A. | 0.5 L 2 mol•L-1 AlCl3溶液中,Al3+和Cl-总数小于4×6.02×1023个 | |
| B. | 制成0.5 L 10 mol•L-1的盐酸,需要标准状况下的氯化氢气体112 L | |
| C. | 从1 L 1 mol•L-1的NaCl溶液中移取出10 mL溶液,其浓度是1 mol•L-1 | |
| D. | 10 g 98%的硫酸(密度为1.84 g•cm-3)与10 mL18.4 mol•L-1的硫酸的浓度不同 |
8.常温下将稀NaOH溶液与稀CH3COOH溶液混合,可能出现的结果是( )
| A. | pH>7,且 c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且 c(CH3COO-)>c(Na+) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
15.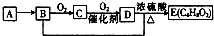 已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如图转化关系则下列推断错误的是( )
已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如图转化关系则下列推断错误的是( )
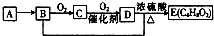 已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如图转化关系则下列推断错误的是( )
已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如图转化关系则下列推断错误的是( )| A. | 鉴别A和甲烷可选择使用酸性高锰酸钾溶液 | |
| B. | D中含有羧基,利用D物质可以清除水壶中的水垢 | |
| C. | 图表涉及的反应类型有加成、取代、氧化 | |
| D. | B+D→E的化学方程式:C2H5OH+CH3COOH→CH3COOC2H5 |
9.乙烷和丙烷的混合气体完全燃烧后,先将产物通过浓硫酸,浓硫酸增重2.04g,然后通过Na2O2 ,Na2O2 增重2.24g,混合气体中乙烷和丙烷的体积比为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:5 |
13.下列方法或试剂不能鉴别甲烷和乙烯的是( )
| A. | 点燃 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 浓硫酸 |
 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: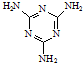 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.