题目内容
19.下列各组物质中分子、离子或晶体的空间结构完全不同的是( )| A. | NH3和H3O+ | B. | NH4+和CH4 | C. | CO2和SiO2 | D. | 金刚石和晶体硅 |
分析 根据价层电子对互斥理论:价层电子对个数=配原子个数+孤电子对个数,再根据价层电子对数判断电子构型,去掉孤电子对即是微粒构型,据此分析,
A.NH3和H3O+都为三角锥形;B.NH4+和CH4都是正四面体结构;C.CO2为直线型分子,SiO2以正四面体为基本结构单元的原子晶体;D.金刚石、晶体硅都以正四面体为基本结构单元的原子晶体.
解答 解:A.氨气分子中氮原子价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,所以氮原子杂化方式是sp3,因为含有一个孤电子对,所以是三角锥型结构,水合氢离子中氧原子价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-2×1-2)=4,含有3个σ键和1个孤电子对,所以其采用sp3杂化,所以是三角锥型结构,两者空间结构完全相同,故A不选;
B.铵根离子中氮原子价层电子对个数=σ键个数+孤电子对个数=4+$\frac{1}{2}$(5-3×1-2)=4,含有4个σ键且不含孤电子对,所以其采用sp3杂化,是正四面体结构;
CH4分子中碳原子价层电子对个数=4+,$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以是正四面体结构,两者空间结构完全相同,故B不选;
C.二氧化碳分子中价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(4-2×2)=2,所以碳原子采取sp杂化,空间构型为直线型,二氧化硅是原子晶体,硅原子采取sp3杂化,Si-O通过共价键形成四面体结构,四面体之间通过共价键无限延伸形成空间网状结构,两者晶体的空间结构完全不同,故C选;
D.金刚石是原子晶体,C-C通过共价键形成四面体结构,四面体之间通过共价键无限延伸形成空间网状结构,晶体硅是原子晶体,Si-Si通过共价键形成四面体结构,四面体之间通过共价键无限延伸形成空间网状结构,两者均采取sp3杂化,晶体的空间结构完全相同,故D不选;
故选C.
点评 本题考查了微粒空间构型的判断,根据价层电子对互斥理论来分析解答即可,该知识点为考试热点,要熟练掌握方法、技巧,难点是孤电子对个数的计算方法,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 植物通过光合作用将CO2转化成葡萄糖是太阳能转变成热能的过程 | |
| B. | 油脂属于酯类化合物,油脂可能使溴水褪色 | |
| C. | 萄糖与果糖互为同分异构体,淀粉与纤维素互为同系物 | |
| D. | 油脂、淀粉、蛋白质和维生素等均为高分子化合物 |
| A. | 需要加热的化学反应都是不自发反应 | |
| B. | 中和反应都是放热反应 | |
| C. | 原电池是将电能转化为化学能的一种装置 | |
| D. | 太阳能电池是将化学能转化为电能的过程 |
| A. | 已知在298K时下述反应的有关数据:C(s)+$\frac{1}{2}$ O2(g)═CO(g)△H1=-110.5 kJ•mol-1C(s)+O2(g)═CO2(g)△H2=-393.5 kJ•mol-1,则C(s)+CO2(g)═2CO(g)△H=-172.5 kJ•mol-1 | |
| B. | KI溶液中滴加过量氯水发生反应的离子方程式为3Cl2+I-+3H2O═6H++IO3-+6Cl- | |
| C. | 等物质的量的NH4HCO3与Ba(OH)2 溶液混合反应的离子方程式为Ba2++HCO3-+OH-═BaCO3↓+H2O | |
| D. | 用铜作电极电解硫酸溶液:2H2O$\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2↑ |
| A. | 0.5 L 2 mol•L-1 AlCl3溶液中,Al3+和Cl-总数小于4×6.02×1023个 | |
| B. | 制成0.5 L 10 mol•L-1的盐酸,需要标准状况下的氯化氢气体112 L | |
| C. | 从1 L 1 mol•L-1的NaCl溶液中移取出10 mL溶液,其浓度是1 mol•L-1 | |
| D. | 10 g 98%的硫酸(密度为1.84 g•cm-3)与10 mL18.4 mol•L-1的硫酸的浓度不同 |
| A. | pH>7,且 c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且 c(CH3COO-)>c(Na+) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
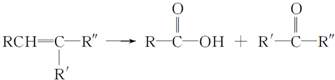
 ,D
,D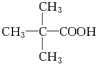 .
. 的路线如下所示,请按要求作答:
的路线如下所示,请按要求作答:
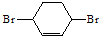 )
)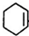 ,F
,F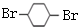 .
. ;④
;④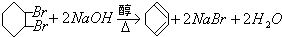 .
.