题目内容
【题目】在容积为10 L的密闭容器中,进行如下反应:A(g)+2B(g)![]() C(g)+D(g),最初加入1.0 mol A和2.2 mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),最初加入1.0 mol A和2.2 mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
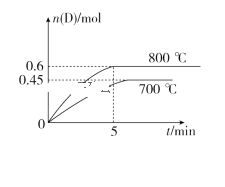
(1)800 ℃时,0~5 min内,以B表示的平均反应速率为________。
(2)能判断该反应达到化学平衡状态的依据是________(填字母)。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)利用图中数据计算800 ℃时的平衡常数K=________,该反应为________反应(填“吸热”或“放热”)。
(4)700 ℃时,某时刻测得另一同体积密闭容器中各物质的量如下:n(A)=1.1 mol,n(B)=2.6 mol,n(C)=0.9 mol,n(D)=0.9 mol,则此时该反应________(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)进行。
【答案】(1)0.24mol/( L·min);(2)A、B(2分,)
(3)0.9(mol·L—1)—1(; 吸热 ; (4)向正反应方向。
【解析】
试题(1)在800℃时,当5min 时D的物质的量是0.6mol,根据方程式中B与D的关系可知:消耗B的物质的量是1.2mol,所以0—5min内,以B表示的平均反应速率为V(B)= 1.2mol÷1L÷5min="0.24mol/(" L·min); (2)A.由于该反应是反应前后气体体积不等的反应,所以若容器中压强不变 ,则反应达到平衡,正确; B.由于该反应是反应前后气体体积不等的反应,所以若反应未达到平衡,则任何物质的浓度就会发生变化,所以若混合气体中c(A)不变,反应达到平衡,正确;C.B是反应物,D都是生成物,若反应达到平衡, v正(B)=2v逆(D),现在 2v正(B)=v逆(D),因此反应未达到平衡,错误; D.在任何时刻都存在c(A)=c(C),因此不能判断反应达到平衡,错误。(3)根据已知条件可知:当反应达到平衡时,各种物质的浓度分别是:c(A)=0.4mol/L;c(B)= 1mol/L;c(C)=c(D)=0.6mol/L。所以800℃时的平衡常数K=![]() 。由于升高温度,D的平衡的物质的量浓度增大,说明升高温度,平衡正向移动,根据平衡移动原理可知,该反应的正反应是吸热反应;(4)在700℃时,根据已知条件可知当反应达到平衡时,各种物质的浓度分别是:c(A)=0.55mol/L;c(B)= 1.3mol/L;c(C)=c(D)=0.45mol/L,在该温度下的化学平衡常数是
。由于升高温度,D的平衡的物质的量浓度增大,说明升高温度,平衡正向移动,根据平衡移动原理可知,该反应的正反应是吸热反应;(4)在700℃时,根据已知条件可知当反应达到平衡时,各种物质的浓度分别是:c(A)=0.55mol/L;c(B)= 1.3mol/L;c(C)=c(D)=0.45mol/L,在该温度下的化学平衡常数是![]() 在某一时刻,各种生成物物质的平衡浓度幂之积与各种反应物的浓度的幂之积的比是
在某一时刻,各种生成物物质的平衡浓度幂之积与各种反应物的浓度的幂之积的比是![]() <0.22,所以此时该反应向正反应方向移动。
<0.22,所以此时该反应向正反应方向移动。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】下列设计的实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1molLFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5ml.0.1mo/L的KMnO4溶液,分别加入2mL0.1mol/L和10.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间 |
C | 证明海带中含有碘元素 | 将海带剪碎、加蒸馏水浸泡,取滤液加几滴稀硫酸和1mLH2O2,再加入几滴淀粉溶液,溶液变蓝 |
D | 验证CH3COONa 溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
A. A B. B C. C D. D
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________,直到因加入一滴盐酸后,溶液由________色变为________色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测NaOH 溶液的体积/mL | 0.100 0 mol·L-1 盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据计算该NaOH溶液的物质的量浓度___________。
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积 (mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14 (填“>”、“<”或“=”![]()
(2)25℃下,某Na2SO4溶液中![]() = 5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) : c(OH-)= ________。
= 5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) : c(OH-)= ________。
(3)在t2 ℃下,pH = 2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=________。
(4)t2 ℃下,将pH = 11的苛性钠溶液V1L与pH = 1的稀硫酸V2 L(混合体积为原两溶液体积之和),所得混合溶液的pH = 2,则V1∶V2 =________。
