题目内容
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积 (mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14 (填“>”、“<”或“=”![]()
(2)25℃下,某Na2SO4溶液中![]() = 5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) : c(OH-)= ________。
= 5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) : c(OH-)= ________。
(3)在t2 ℃下,pH = 2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=________。
(4)t2 ℃下,将pH = 11的苛性钠溶液V1L与pH = 1的稀硫酸V2 L(混合体积为原两溶液体积之和),所得混合溶液的pH = 2,则V1∶V2 =________。
【答案】>1000︰11×10-10mol/L9︰11
【解析】
(1)根据水的电离过程为吸热反应进行判断;
(2)根据硫酸钠的化学式组成判断c(Na+):c(SO42-),根据常温下氢离子浓度计算c(Na+) : c(OH-);
(3)酸溶液中氢氧根离子浓度为水电离出的;t2 ℃下,pH=2的硫酸溶液中水电离出的c(H+)水=c(OH-)水;
(4)混合液的pH=2,酸过量,根据c(H+)=(n(H+)-n(OH-))/V总进行计算。
(1)水是弱电解质,存在电离平衡,电离过程为吸热反应,所以温度升高,水的电离程度增大,离子积增大;因此,本题正确答案是: >。
(2)硫酸钠溶液中一定满足c(Na+):c(SO42-)=2:1,硫酸钠溶液中c(Na+)=2×5×10-4mol/L=10-3mol/L,稀释后c(Na+)=10-3/10=10-4mol/L,溶液呈中性,c(OH-)=10-7 mol/L,则稀释后溶液中c(Na+) : c(OH-)= 10-4:10-7=1000︰1;综上所述,本题答案是:1000︰1。
(3)酸溶液中,溶液中的氢氧根离子是由水电离产生的,因此在t2 ℃下,pH=2的稀硫酸溶液中,c(H+)=10-2mol/L,因为Kw=1×10-12,所以c(H+)水=c(OH-)水= 1×10-10mol/L;综上所述,本题答案是:1×10-10mol/L。
(4)t2 ℃下, Kw=1×10-12,pH = 11的苛性钠溶液,c(OH-)=10-1mol/L,混合液的pH =2,酸过量, c(H+)混=(n(H+)-n(OH-))/V总=(0.1×V2 -0.1×V1)/( V2+ V1)=0.01,解之得V1∶V2 = 9︰11;综上所述,本题答案是:9︰11。

【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
【题目】25℃时,三种酸的电离平衡常数如下:回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)一般情况下,当温度升高时,电离平衡常数K________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力最强的是______(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=CO32-+2HClO
(4)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
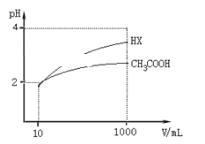
则HX的电离平衡常数________(填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)_____醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____HX。