题目内容
【题目】CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

(1)用离子方程式表示Na2CrO4溶液中的转化反应____________。
(2)由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”),溶液中c(Cr2O72-)与c(CrO42-)的比值将_____________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为________________ (水的浓度不计入平衡常数表达式)。
(3)升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
(4)向K2Cr2O7溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液的pH下降,生成的砖红色沉淀的化学式为_______________。
(5)+6价铬的化合物毒性较大,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,反应的离子方程式为______________。
【答案】2CrO42-+2H+![]() Cr2O72-+H2O增大增大1.0×1014小于Ag2CrO43H2C2O4 + Cr2O72-+ 8H+ = 2Cr3+ + 7H2O +6CO2
Cr2O72-+H2O增大增大1.0×1014小于Ag2CrO43H2C2O4 + Cr2O72-+ 8H+ = 2Cr3+ + 7H2O +6CO2
【解析】
(1)已知CrO42和Cr2O72在溶液中可相互转化,所以离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O,
Cr2O72-+H2O,
故答案为:2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(2)由图可知,溶液酸性增大,c(Cr2O72)增大,所以CrO42的平衡转化率增大;溶液中c(Cr2O72-)与c(CrO42-)的比值将增大;
A点处c(H+)=1.0×10-7mol/L,c(Cr2O72)=0.25mol/L,c(CrO42)=1.0mol/L-2c(Cr2O72)=(1-2×0.25)mol/L=0.50mol/L,则平衡常数为K=![]() =1.0×1014,
=1.0×1014,
故答案为:增大;增大;1.0×1014 ;
(3)升高温度,溶液中CrO42的平衡转化率减小,平衡逆向移动,说明正方向放热,则该反应的ΔH小于0,
故答案为:小于;
(4)向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,平衡:2CrO42-+2H+![]() Cr2O72-+H2O向左移动,生成砖红色沉淀且溶液的pH下降,应是Ag+与CrO42-结合生成砖红色沉淀,故该砖红色沉淀为Ag2CrO4,
Cr2O72-+H2O向左移动,生成砖红色沉淀且溶液的pH下降,应是Ag+与CrO42-结合生成砖红色沉淀,故该砖红色沉淀为Ag2CrO4,
故答案为:Ag2CrO4;
(5)H2C2O4将废液中的Cr2O72-转化为Cr3+,H2C2O4被氧化为CO2,根据得失电子守恒写出并配平离子方程式为3H2C2O4 + Cr2O72-+ 8H+ = 2Cr3+ + 7H2O +6CO2,
故答案为:3H2C2O4 + Cr2O72-+ 8H+ = 2Cr3+ + 7H2O +6CO2。

【题目】某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
② | _____ | _____ | _____ | |
③ | _____ | _____ | _____ | |
④ | _____ | _____ | _____ |
(2)实验装置如图1所示,如何检验该装置的气密性________________________________

(3)实验①中CO2质量随时间变化的关系见下图2:依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70-90 s范围内HNO3的平均反应速率________________________
(4)请在答题卡的框图中,画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。_______
【题目】全国平板玻璃生产企业大气污染物年排放总量逐年增加,对氮氧化物(NOx)排放的控制与监测已刻不容缓。回答下列问题:
(1)平板玻璃熔窑烟气中的NOx以温度型氮氧化物为主。其中NO在空气中容易被一种三原子气体单质氧化剂和光化学作用氧化成NO2,该氧化剂的分子式为_________。
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,2NO2(g)+N2(g)
4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,2NO2(g)+N2(g)![]() 4NO(g) ΔH=+293 kJ·mol-1,则反应CH4(g)+4NO(g)
4NO(g) ΔH=+293 kJ·mol-1,则反应CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)的ΔH=_________kJ·mol-1。
2N2(g)+CO2(g)+2H2O(g)的ΔH=_________kJ·mol-1。
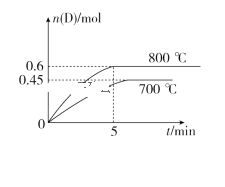
(3)800℃时,在刚性反应器中以投料比为1:1的NO(g)与O2(g)反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
p/kPa | 33.2 | 28.6 | 27.1 | 26.3 | 25.9 | 25.2 | 22.3 |
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=52 min时,测得体系中p(O2)=11.4 kPa,则此时的p(NO)=_________kPa,v=_________kPa·min-1(计算结果保留1位小数)。
②若升高反应温度至900℃,则NO(g)与O2(g)完全反应后体系压强p∞(900℃)_________(填“大于”“等于”或“小于”)22.3kPa,原因是___________________________________。
③800℃时,反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
2NO2(g)的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,计算结果保留2位小数)。
(4)对于反应2NO(g)+O2(g)![]() 2NO2(g),科研工作者提出如下反应历程:
2NO2(g),科研工作者提出如下反应历程:
第一步:2NO(g)![]() N2O2(g) 快速平衡
N2O2(g) 快速平衡
第二步:N2O2+O2(g)![]() 2NO2(g) 慢反应
2NO2(g) 慢反应
下列表述正确的是_________(填标号)。
A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物为N2O2
C.第二步中N2O2与O2的碰撞全部有效 D.第二步反应活化能较低
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2