题目内容
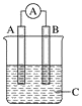
【题目】关于从碘水中萃取碘的实验,下列说法错误的是( )
A.分液漏斗使用前要检验其是否漏液
B.萃取剂要求不溶于水,且碘在其中的溶解度比在水中的大
C.注入碘水和萃取剂,倒转分液漏斗反复用力振荡后立即分液
D.该实验需要选用的仪器是烧杯、分液漏斗、铁架台(带铁圈)
【答案】C
【解析】
A. 分液漏斗有活塞和玻璃塞,为防止漏液,使用前要检查分液漏斗是否漏液,A正确;
B. 萃取剂不溶于水,不与水、碘反应,且碘在萃取剂中的溶解度比在水中的大,B正确;
C. 振荡后需要静置分层后,在进行分液操作,C错误;
D. 萃取实验中所用的仪器:烧杯、分液漏斗、铁架台(带铁圈),D正确;
故答案为:C。

 考前必练系列答案
考前必练系列答案【题目】某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后强热可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体。
请回答下列问题:
(1)请写出步骤一的化学方程式____________________________,此反应不能用瓷坩埚,原因是(用化学方程式表示)_________________________________;
(2)否用浓盐酸代替步骤二中的CO2 ,请简要分析原因__________________________;
(3)部分化合物的溶解度随温度的变化如下表所示,从步骤二反应后的混合溶液中分离得到高锰酸钾晶体的方法是蒸发浓缩、_____________,过滤、洗涤、烘干。为进一步增加得到的产品(高锰酸钾晶体)的纯度,常采用的实验方法是____________;
一些化合物的溶解度S/g(100g H2O)-1
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 |
K2CO3 | 51.3 | 52.0 | 52.5 | 53.2 | 53.9 | 54.8 |
KMnO4 | 2.83 | 4.4 | 9.0 | 12.7 | 16.9 | 22.2 |
(4)按以上方法制备高锰酸钾,每3 mol K2MnO4彻底反应理论上生成_________mol KMnO4;为增大锰酸钾的原子利用率,更好的制备方法是电解法。以K2MnO4溶液为电解液,采用惰性电极电解,当阴极在标准状况下产生5.6 L H2时,产生KMnO4的物质的量是________mol。
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2