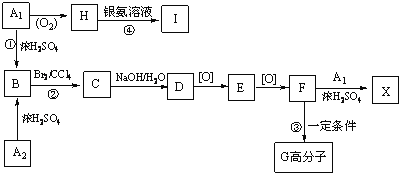
题目内容
【题目】下列设计的实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1molLFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5ml.0.1mo/L的KMnO4溶液,分别加入2mL0.1mol/L和10.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间 |
C | 证明海带中含有碘元素 | 将海带剪碎、加蒸馏水浸泡,取滤液加几滴稀硫酸和1mLH2O2,再加入几滴淀粉溶液,溶液变蓝 |
D | 验证CH3COONa 溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
A. A B. B C. C D. D
【答案】D
【解析】A、KI与FeCl3发生氧化还原反应,其离子反应为2Fe3++2I-=2Fe2++I2,因为KI是过量,因此溶液中存在I-和I2,不能说明反应是可逆反应,故A错误;B、酸性高锰酸钾溶液与草酸反应的离子方程式为:2MnO4-+5H2C2O4+6H+=8H2O+10CO2↑+2Mn2+,高锰酸钾过量,溶液不褪色,故B错误;C、海带剪碎,加蒸馏水,海带中I元素不能进入溶液中,应剪碎后点燃,然后加蒸馏水,过滤,故C错误;D、CH3COONa溶液中存在CH3COO-+H2O![]() CH3COOH+OH-,加入酚酞,溶液变红,加入醋酸铵固体,醋酸铵溶液呈中性,CH3COO-的浓度增大,平衡向正反应方向移动,颜色加深,故D正确。
CH3COOH+OH-,加入酚酞,溶液变红,加入醋酸铵固体,醋酸铵溶液呈中性,CH3COO-的浓度增大,平衡向正反应方向移动,颜色加深,故D正确。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目