题目内容
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是(用离子方程式表示).
(2)常温下,取0.2molL﹣1 HCl溶液与0.2molL﹣1 MOH溶液等体积混合,测得混合溶液后的pH=5.写出MOH的电离方程式: .
(3)0.1mol/L的NaHA溶液中,测得溶液中的显碱性.则
①该溶液中c(H2A)c(A2﹣)(填“>”、“<”或“=”).
②作出上述判断的依据是(用文字解释).
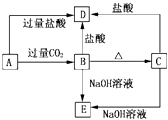
(4)含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10﹣3 molL﹣1的Cr2O72﹣ . 为了使废水的排放达标,进行如下处理: ![]()
①绿矾为FeSO47H2O.反应(I)中Cr2O72﹣与FeSO4的物质的量之比为 .
②常温下若处理后的废水中c(Cr3+)=6.0×10﹣7 molL﹣1 , 则处理后的废水的pH= . (Ksp[Cr(OH)3]=6.0×10﹣31)
【答案】
(1)Al3++3H2O?Al(OH)3+3H+
(2)MOH?M++OH﹣
(3)>;NaHA溶液显碱性,说明其电离程度小于水解程度
(4)1:6;6
【解析】解:(1)明矾溶于水电离出铝离子,铝离子易水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中的悬浮物而净水,所以明矾能净水,离子方程式为Al3++3H2OAl(OH)3+3H+ , 所以答案是:Al3++3H2OAl(OH)3+3H+;(2)等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,弱碱电离可逆,其电离方程式为:MOHM++OH﹣ , 所以答案是:MOHM++OH﹣;(3)①NaHA溶液中,HA﹣离子既电离也水解,电离产生A2﹣ , 水解生成H2A,溶液显碱性,说明其电离程度小于水解程度,所以c(H2A)>c(A2﹣)所以答案是:>;②NaHA溶液中,HA﹣离子既电离也水解,电离产生A2﹣ , 水解生成H2A,溶液显碱性,说明其电离程度小于水解程度,
所以答案是:NaHA溶液显碱性,说明其电离程度小于水解程度;(4)①依据氧化还原反应离子方程式:6Fe2++Cr2O72﹣+14H+=6Fe3++2Cr3++7H2O可以求得Cr2O72﹣与FeSO4的物质的量之比为1:6,所以答案是:1:6;②Ksp[Cr(OH)3]=c(Cr3+)c3(OH﹣)=c3(OH﹣)×6.0×10﹣7=6.0×10﹣31 , c(OH﹣)=1.0×10﹣8 , 其pH=6,所以答案是:6.
【考点精析】利用弱电解质在水溶液中的电离平衡对题目进行判断即可得到答案,需要熟知当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

 阅读快车系列答案
阅读快车系列答案【题目】如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).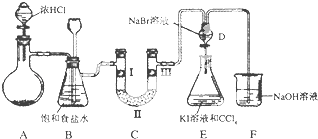
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是 , 若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入;(提示:硅胶是干燥剂,不与氯气反应)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,D中发生反应的离子方程式为 , 若打开D装置的活塞,使D中溶液滴入E装置,振荡锥形瓶后静置一会儿,可以观察到的现象是 .
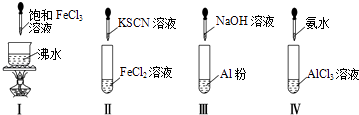
【题目】下列实验能达到相应实验目的的是
选项 | 实验内容 | 实验目的 |
A | 在5mL 0.005mol/L FeCl3和5mL 0.1mol/L KSCN的混合溶液中,加入饱和FeCl3溶液,溶液的红色加深 | 验证浓度对化学平衡的影响 |
B | 室温下,用pH试纸测定浓度为0.1mol·L-1 NaClO溶液和0.1mol·L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C | 常温下,测得浓度均为0.1mol/L溶液的pH:NaA>NaB | 证明常温下的Ka:HA<HB |
D | 等体积、pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多 | 证明HA是强酸 |
A. A B. B C. C D. D