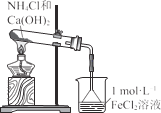
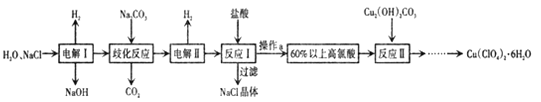
题目内容
【题目】在通常状况下,A为固态单质。根据如图所示转化关系,回答:

(1)写出A、C、E的化学式:
A.__________,C.__________,E.__________。
(2)写出下列反应的化学方程式:
①E→C___________________________________。
②C→D_________________________。
(3)B与E的浓溶液__________(填“能”或“不能”)发生反应,若能反应,则反应的化学方程式为___,反应现象为_________。
(4)将C通入BaCl2溶液中,没有明显现象,但若加入H2O2,则有白色沉淀生成,请分析其原因:__,并写出有关的化学方程式______。
【答案】S SO2 H2SO4 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 2SO2+O2
CuSO4+SO2↑+2H2O 2SO2+O2![]() 2SO3 能 H2S+H2SO4(浓)==S↓+SO2↑+2H2O 溶液变浑浊,有刺激性气味的气体放出 H2O2能把SO2氧化为H2SO4 H2O2+SO2==H2SO4,H2SO4+BaCl2==BaSO4↓+2HCl
2SO3 能 H2S+H2SO4(浓)==S↓+SO2↑+2H2O 溶液变浑浊,有刺激性气味的气体放出 H2O2能把SO2氧化为H2SO4 H2O2+SO2==H2SO4,H2SO4+BaCl2==BaSO4↓+2HCl
【解析】
A为固态单质,能与氢气反应,应为非金属单质,由题中转化关系,可知A为S,则B为H2S,C为SO2,D为SO3,E为H2SO4,据此分析解答。
(1)A通常状态下为固态单质,能与氢气反应,应为非金属单质,由题中转化关系,可知A为S,则B为H2S,C为SO2,D为SO3,E为H2SO4,故答案为:S;SO2;H2SO4;
(2)①E→C的反应方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;②C→D的反应方程式为:2SO2+O2
CuSO4+SO2↑+2H2O;②C→D的反应方程式为:2SO2+O2![]() 2SO3,故答案为:Cu+2H2SO4(浓)
2SO3,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;2SO2+O2
CuSO4+SO2↑+2H2O;2SO2+O2![]() 2SO3;
2SO3;
(3)硫化氢与浓硫酸能够发生氧化还原反应,反应方程式为:H2S+H2SO4(浓)=S↓+SO2↑+2H2O,产生淡黄色沉淀及无色有刺激性气味的气体,故答案为:能;H2S+H2SO4(浓)=S↓+SO2↑+2H2O;产生淡黄色沉淀,有无色有刺激性气味的气体放出;
(4)将二氧化硫通入BaCl2溶液中,没有明显现象,但若加入H2O2,则有白色沉淀生成,是因为H2O2能把SO2氧化为H2SO4,硫酸与氯化钡反应生成硫酸钡白色沉淀,反应的化学方程式为H2O2+SO2=H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,故答案为:H2O2能把SO2氧化为H2SO4;H2O2+SO2=H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓