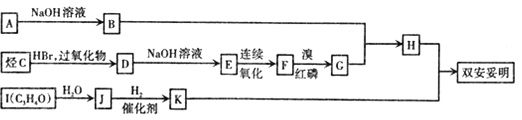
题目内容
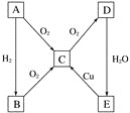
【题目】高氯酸铜易溶于水,在130'℃时会发生分解反应,是一种燃烧催化剂,以食盐等为原料制备高氯酸铜 [ Cu(ClO4)26 H2O) ]的一种工艺流程如下:
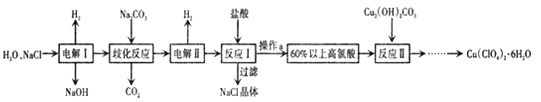
回答下列问题
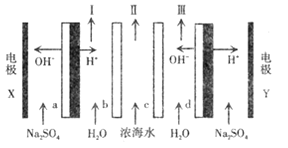
(1)“电解I”的化学方程式为_________,所用交换膜是_(填“阳离子交换膜或“阴离子交换膜”) 。
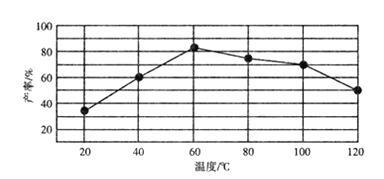
(2)歧化反应是同一种物质中同种元素(自身氧化还原反应 ,已知上述工艺流程中“歧化反应”的产物之一为 NaClO3
①“歧化反应”的化学方程式为_。
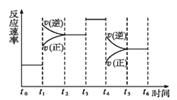
②“歧化反应”阶段不同温度对产率影响的结果如图所示。则该反应最适宜的温度是______。
(3)“电解II”的阳极产物为 ______(填离子符号).
(4) 该流程中可循环利用的物质是 _________(填化学式) 。
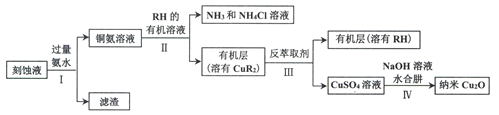
(5) 用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a千克。 最终制得的Cu( ClO4)2 6 H2O为b千克.则产率为_____(用含a、 b 的代数式表示) 。
(6) 某温度下 ,高氯酸铜可按A、B 两种方式同时分解.分解过程中铜的化合价不发生改变。A方式为Cu( ClO4)2![]() CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
【答案】2NaCl+2 H2O ![]() 2NaOH+H2↑+Cl2↑ 阳离子交换膜 3Na2CO3+3Cl2 = 5NaCl+NaClO3+3CO2 60℃ ClO4- NaCl (702b/371a)×100% 2 Cu(ClO4)2
2NaOH+H2↑+Cl2↑ 阳离子交换膜 3Na2CO3+3Cl2 = 5NaCl+NaClO3+3CO2 60℃ ClO4- NaCl (702b/371a)×100% 2 Cu(ClO4)2 ![]() 2Cu O+7O2↑+2Cl2↑
2Cu O+7O2↑+2Cl2↑
【解析】
以食盐为原料制备高氯酸铜[Cu(ClC4)2·6H2O)],则生成产物为高氯酸钠,电解氯化钠溶液生成氢氧化钠、氢气和氯气,“歧化反应”时,高氯酸钠与碳酸钠溶液发生歧化反应,生成的产物之一为氯酸钠,同时生成二氧化碳气体,通电电解,溶液其中氯酸根离子失电子发生氧化反应生成高氯酸根离子,加入盐酸,过滤除去氯化钠晶体,得到60%以上的高氯酸,“反应Ⅱ”阶段,Cu2(OH)2CO3与HClO4反应经过一系列操作后得到蓝色Cu(C1O4)2溶液,据此分析解答。
(1)根据上述分析可知,反应Ⅰ为电解氯化钠溶液生成氢氧化钠、氢气和氯气,反应的化学方程式为2NaCl+2 H2O ![]() 2NaOH+H2↑+Cl2↑,反应过程中需要防止氢氧根离子与氯气反应,所用的交换膜是阳离子交换膜,故答案为:2NaCl+2 H2O
2NaOH+H2↑+Cl2↑,反应过程中需要防止氢氧根离子与氯气反应,所用的交换膜是阳离子交换膜,故答案为:2NaCl+2 H2O ![]() 2NaOH+H2↑+Cl2↑;阳离子交换膜;
2NaOH+H2↑+Cl2↑;阳离子交换膜;
(2)①“歧化反应”是氯气反应生成氯化钠和NaClO3,氯元素从0价目变为-1价和+5价,同时生成二氧化碳,反应的化学方程式为3Na2CO3+3Cl2=5NaCl+NaClO3+3CO2,故答案为:3Na2CO3+3Cl2=5NaCl+NaClO3+3CO2;
②根据图中信息可知,“歧化反应”阶段在60℃时,产率达最高80%,故答案为:60℃;
(3)通过电解,溶液中氯酸根离子失电子发生氧化反应在阳极生成高氯酸根离子,“电解Ⅱ”的阳极氯离子失电子产物为ClO4-,故答案为:ClO4-;
(4)由上述分析可知,该流程中可循环利用的物质是NaCl,故答案为:NaCl;
(5)根据流程图,氯化钠电解生成的氯气与碳酸钠生成氯酸钠和氯化钠,电解后氯酸钠变成高氯酸钠,加入盐酸反应生成高氯酸,最后与Cu2(OH)2CO3反应生成Cu(ClO4)2·6H2O,假设起始是氯化钠为6mol,则生成的氯气为3mol,得到1mol氯酸钠,根据氯元素守恒最终得到0.5molCu(ClO4)2·6H2O,因此产率=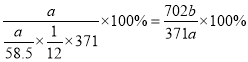 ,故答案为:(702b/371a)×100%;
,故答案为:(702b/371a)×100%;
(6)A方式Cu(ClO4)2![]() CuCl2+4O2↑中氧元素由-2价变为0价转移电子为4×2×2=16,氯由+7价变为-1价,转移电子为8×2=16,若4 mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式可能氯由+7价变为0价,转移电子为7×2=14,氧元素由-2价变为0价转移电子为3.5×2×2=14,综合可知生成物为氧气、氯气和氧化铜,故反应为2Cu(C1O4)2
CuCl2+4O2↑中氧元素由-2价变为0价转移电子为4×2×2=16,氯由+7价变为-1价,转移电子为8×2=16,若4 mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式可能氯由+7价变为0价,转移电子为7×2=14,氧元素由-2价变为0价转移电子为3.5×2×2=14,综合可知生成物为氧气、氯气和氧化铜,故反应为2Cu(C1O4)2![]() 2CuO+7O2↑+2C12↑,故答案为:2Cu(C1O4)2
2CuO+7O2↑+2C12↑,故答案为:2Cu(C1O4)2![]() 2CuO+7O2↑+2C12↑。
2CuO+7O2↑+2C12↑。

【题目】乙二醇是工业常见的有机原料,常用来制取纺织工业的乙二醛和化妆品行业的乙醛酸。
①乙二醇(HOCH2CH2OH)气相催化氧化法制取乙二醛(OHC-CHO),主要反应为:HOCH2CH2OH(g)+O2(g)![]() OHC—CHO(g)+2H2O(g) H
OHC—CHO(g)+2H2O(g) H
化学键 | O—H | C—H | C—O | C=O | O=O | C—C |
键能(kJ·mol-1) | 436 | 413 | 356 | 745 | 493 | 346 |
则H=_____kJ·mol-1。
②当原料气中氧醇比(氧气和乙二醇的物质的量之比)一定时,乙二醛和副产物CO2的产率与反应温度的关系如图所示,则反应中应控制的适宜温度是___(填字母)。
a.低于450℃
b.450℃~490℃
c.高于495℃
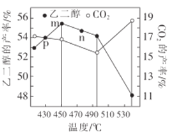
p、m、n三点中____是平衡点,__是逆反应速率最快的点。
③温度超过495℃时,乙二醛的产率直线下降的原因是___。
(2)将乙二醇氧化为乙二酸,再利用乙二酸(HOOCCOOH)通过电解制备乙醛酸,阴极的电极反应式为____。
(3)液相氧化制备乙醛酸是近年研究的热点。向25L某浓度的乙二醛溶液中,加入适量的催化剂V2O5/C,以0.1mol·L-1的流速通入氧气,测得溶液中乙二醛的浓度、溶液的pH随时间变化的关系如图所示:
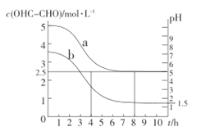
①图中曲线___(填“a”或“b”)表示溶液的pH值随时间变化的曲线。
②V2O5/C表示将催化剂覆盖在纳米碳纤维上,其目的是___。
③写出制备乙醛酸(HOC—COOH)的化学反应方程式:____,根据图中数据算出8h内乙醛酸的平均生成速率v(HOC—COOH)=____;该实验条件下乙醛酸的电离常数Ka=___。