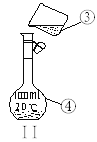
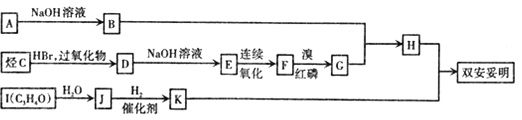
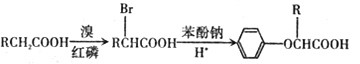题目内容
【题目】已知①---⑩号元素在周期表中的位置如图。试回答下列问题:

(1)上述元素中属于d区的有:________。
(2)②、③、④三种元素的第一电离能由大到小的顺序为_________(用元素符号表示)。
(3)⑧号元素在元素周期表中的位置是_______________,其原子核外未成对电子数为_______________,⑩号原子处于基态时核外电子排布式为___________,已知元素⑩和⑦的电负性分别为1.9和2.5,则⑩与⑦形成的化合物属于__________(填“离子”或“共价”)化合物。
(4)③号元素原子与①号元素原子形成的原子个数比为![]() 的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
的分子X在①与④形成的化合物Y中的溶解度很大,其主要原因是____________。
(5)④号和⑦号元素组成的原子个数比为3:1的-2价阴离子的空间构型、中心原子的杂化类型分别是:____________,____________。
【答案】Fe、Ni N>O>C 第四周期第Ⅷ族 4 1s22s22p63s23p63d104s1 共价 水和氨气分子间能形成氢键、水和氨气分子都是极性分子 三角锥型 sp3
【解析】
根据元素周期表结构可知,①~⑩号元素分别为氢元素、碳元素、氮元素、氧元素、钠元素、磷元素、硫元素、铁元素、镍元素、铜元素;
(1)d区包括ⅢB族~ⅥIB族、第ⅥII族;
(2)同周期主族元素随原子序数增大第一电离能呈增大趋势,N元素2p能级为半满稳定状态,能量较低,第一电离能高于氧元素的;
(3)⑧为铁元素,原子序数为26,结合图示判断在周期表中位置;⑩为Cu,原子序数为29,结合构造原理书写核外电子排布式;根据两种元素电负性差值大于1.7时为离子化合物,小于1.7时为共价化合物的经验规则可以判断;
(4)③号元素原子与①号元素原子形成的原子个数比为1:3的分子X为氨气,氨气为三角锥形;①与④形成的化合物Y为水,结合水和氨气分子间能形成氢键和相似相溶原理分析;
(5)④号和⑦号元素组成的原子个数比为3:1的-2价阴离子为SO32-,根据价层电子对分析空间构型、中心原子的杂化类型。
①~⑩号元素分别为氢元素、碳元素、氮元素、氧元素、钠元素、磷元素、硫元素、铁元素、镍元素、铜元素;
(1)d区包括ⅢB族~ⅥIB族、第ⅥII族,则上述元素中属于d区的元素有Fe和Ni;
(2)同周期主族元素随原子序数增大第一电离能呈增大趋势,N原子2p轨道为半充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能N>O,则第一电离能大小顺序为:N>O>C;
(3)⑧号元素为Fe,根据元素周期表结构可知,Fe位于第四周期第Ⅷ族,核电荷数为26,其电子排布式为1s22s22p63s23p63d64s2,价电子排布图为![]() ,则原子核外未成对电子数为4;⑩为Cu,原子序数为29,其核外电子排布式为1s22s22p63s23p63d104s1;已知元素⑩和⑦的电负性分别为1.9和2.5,二者电负性之差为0.6<1.7,则⑩与⑦形成的化合物属于共价化合物;
,则原子核外未成对电子数为4;⑩为Cu,原子序数为29,其核外电子排布式为1s22s22p63s23p63d104s1;已知元素⑩和⑦的电负性分别为1.9和2.5,二者电负性之差为0.6<1.7,则⑩与⑦形成的化合物属于共价化合物;
(4)③号元素原子与①号元素原子形成的原子个数比为1:3的分子X为氨气,氨气为极性分子;①与④形成的化合物Y为水,由于水和氨气分子间能形成氢键、水和氨气分子都是极性分子,所以氨气在水中的溶解度很大;
(5)④号和⑦号元素组成的原子个数比为3:1的-2价阴离子为SO32-,中心原子价层电子对数为3+![]() =4,其中有1个孤电子对,则空间构型为三角锥型,杂化类型是sp3。
=4,其中有1个孤电子对,则空间构型为三角锥型,杂化类型是sp3。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案