��Ŀ����
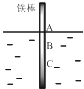
����Ŀ������[KAl(SO4)2��12H2O]��һ���Σ�����ֽ�ȷ���Ӧ�ù㷺��ij��ȤС�����10.0g��������(��90%��Al��������������Fe��Mg�����ʣ��Ʊ�������ʵ�鷽�����£�
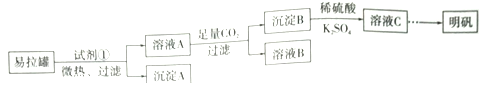
��1���Լ���Ӧѡ��_____________(����ţ���
a.���� b.H2SO4��Һ c.�Ȼ�����Һ d.NaOH��Һ
��2���������ܽ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ____________________��
��3����ҺB�����ʵ���Ҫ�ɷ�Ϊ____________________ (�ѧʽ)��
��4������ҺC�еõ�������ʵ���������Ϊ����Ũ����__________(��������ƣ������ˡ�ϴ�ӡ��������ͼ��ʾ�����������е�һ��������_____________��
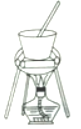
��5����С����ʵ�����֮�õ�118.5 g�������������Ļ�����Ϊ_____________������֪��������Ħ������Ϊ474g��mol-1)
���𰸡� d 2Al+2NaOH+2H2O=2NaAlO2+3H2�� NaHCO3 ��ȴ�ᾧ ����ʱ����ʹ������(������ʱӦʹ��Ӧ������) 75%
����������������Ҫ�ɷ�ΪAl������������Fe��Mg���ʣ���ѡ��ŨNaOH�ܽ⣬�õ�ƫ��������Һ����ҺA������ͨ�����˳�ȥFe��Mg������A�������ʣ���Һ��ͨ��CO2��Һ��������������������̼�����ƣ�ͨ�����˵õ�̼��������Һ����ҺB������������������B�������˺����ܽ���ϡ�����У��õ���������Һ������K2SO4��Һ������Ũ������ȴ�ᾧ�õ��������塣��
��1�����������ܽ���ǿ���ǿ������Һ��������þֻ���ܽ���ǿ������Һ�е����ʲ��죬��ѡ��NaOH��Һ�ܽ������ޣ��ɳ�ȥ���е�����þ�����ʣ���ѡd����2����������������Һ��Ӧ����ƫ�����ƺ�������������Ӧ�Ļ�ѧ����ʽΪ2Al+2NaOH+2H2O��2NaAlO2+3H2������3�����ݷ�����֪��ƫ��������Һ��ͨ��CO2��Һ��������������������̼�����ƣ�ͨ�����˵õ�̼��������Һ����ҺB������������������B������ҺBΪNaHCO3��Һ����4����������Һ������K2SO4��Һ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ��������壻��������ʹ��������Ӧ��������������2��������Ԫ���غ��֪�����Ͽɵõ�����������Ϊ��10g��90%��474/27=158g���������Ļ�����Ϊ118.5/158��100%=75%��

����Ŀ��X��Y��Z��Q��MΪ�����Ķ�����Ԫ�أ���ԭ���������������й���Ϣ�����
X | ��ֲ����������ȱ�ٵ�Ԫ�أ��ǵ����ʵ���Ҫ�ɷ� |
Y | �ؿ��к����ӵ�һλ |
Z | ����������ԭ�Ӱ뾶��� |
Q | �����д���ʹ����Ͻ���Ʒ����ҵ�Ͽ��õ����������ķ����Ʊ��䵥�� |
M | ��ˮ�д���������Ԫ��֮һ������������ϼ��븺�۵Ĵ�����Ϊ6 |
��1��X����̬�⻯��Ĵ���������������˵���������ʳ��������µļ������������⣬��д������̬�⻯��ĵ���ʽ ��
��2����֪37Rb��53I��λ�ڵ������ڣ��ֱ���Z��Mͬһ���壮�����й�˵����ȷ����������ţ���
A.ԭ�Ӱ뾶��Rb��I
B.RbM�к��й��ۼ�
C.��̬�⻯�����ȶ��ԣ�M��I
D.Rb��Q��M������������Ӧ��ˮ�����������������Ӧ
��3��������QX�����Ժã�������ϵ��С�������õ����ȳ�����ϣ��йػ�����QX���Ʊ�����ѧ�������£������������ݾ����ۺ�Ϊ25�桢101.3 kPa�����µ���ֵ�����ٿ���Q��X�ĵ�����800��1 000���Ƶã�ÿ����1 mol QX������a kJ��������
�ڿ���Q���������̿��X�ĵ�����1 600��1 750������QX��ÿ����18 g̼����1 mol QX������b kJ��������
�����������Ϣд����������Q�����������̿��Ӧ����Q���ʺ�CO���Ȼ�ѧ����ʽ ��
��4��X��Y��ɵ�һ����ɫ������������Ϊ����ɫ����״���½�40 L����ɫ������15 L����ͨ��һ��Ũ�ȵ�NaOH��Һ�У�ǡ�ñ���ȫ���գ�ͬʱ���������Σ���д���÷�Ӧ�����ӷ���ʽ ��